
| A. | 原子半径:Br>Cl>P | B. | 热稳定性:AsH3>PH3 | ||
| C. | 碱性:CsOH>Ca(OH)2 | D. | 酸性:H3AsO4>H3PO4 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
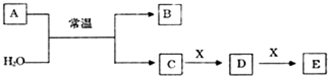
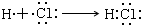 .
.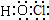 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ①②④⑤ | C. | ②③⑤⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的三种金属分别与足量的硫酸反应,金属钠放出H2最多 | |
| B. | 未经打磨的铝箔和经过打磨的铝箔,分别在酒精灯上加热至融化,前者融化不滴落,后者融化后滴落 | |
| C. | 铁表面的氧化膜是疏松的,不能保护内层的铁 | |
| D. | 钠跟氯化铜溶液反应,有红色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com