
【题目】硅单质及其化合物应用范围很广,请回答下列问题:
制备硅半导体材料必须先得到高纯硅,三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)写出由纯SiHCl3制备高纯硅的化学反应方程式___________;
(2)整个制备过程必须严格控制无水无氧,SiHCl3遇水剧烈反应生成H2SiO3,HCl和另一种物质,写出配平的化学反应方程式___________; H2还原SiHCl3过程中若混入O2,可能引起的后果是_________。
【答案】SiHCl3+H2![]() Si+3HCl SiHCl3+3H2O=H2SiO3↓+3HCl↑+H2↑ 氧气与氢气混合,可能引起爆炸、氧气可能会氧化SiHCl3
Si+3HCl SiHCl3+3H2O=H2SiO3↓+3HCl↑+H2↑ 氧气与氢气混合,可能引起爆炸、氧气可能会氧化SiHCl3
【解析】
(1)纯SiHCl3与H2在1357K下反应产生Si单质和HCl,据此可书写有关反应方程式;
(2)SiHCl3遇水反应产生H2SiO3、HCl,然后根据反应前后元素守恒,分析另外一种物质的成分,并书写相应的化学方程式;H2、O2的混合气体遇明火会发生爆炸。
(1)纯SiHCl3与H2在1357K下反应产生Si单质和HCl,该反应方程式为SiHCl3+H2![]() Si+3HCl;
Si+3HCl;
(2)SiHCl3遇水反应产生H2SiO3、HCl等,然后根据反应前后元素守恒,分析另外一种物质的成分是H2,据此可得相应的化学方程式为SiHCl3+3H2O=H2SiO3↓+3HCl↑+H2↑;H2还原SiHCl3过程中若混入O2,H2、O2的混合气体可能会发生爆炸,并且氧气可能会氧化SiHCl3。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关于基本营养物质说法不正确的是
A.家庭做菜用的菜籽油、花生油和猪油都属于酯类
B.疫苗需冷冻保藏,是防止蛋白质变性
C.蔗糖水解得到葡糖糖和果糖,麦芽糖水解只得到葡萄糖,蔗糖和麦芽糖是同分异构体
D.糖类和蛋白质都是人体必需的营养物质,都属于高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题。
Ⅰ.已知H—H键的键能为436kJ·mol-1,N—H键的健能为391kJ·mol-1,N![]() N键的键能是945.6 kJ·mol-1,则反应NH3(g)
N键的键能是945.6 kJ·mol-1,则反应NH3(g)![]()
![]() N2(g)+
N2(g)+![]() H2(g)的ΔH=______,若在某温度下其平衡常数为K,则N2(g)+3H2(g)
H2(g)的ΔH=______,若在某温度下其平衡常数为K,则N2(g)+3H2(g) ![]() 2NH3(g)的平衡常数K1=___________(用K表示)
2NH3(g)的平衡常数K1=___________(用K表示)
Ⅱ.氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯氨、二氯氨和三氯氨(NH2Cl、NHCl2和NCl3),副产物少于其它水消毒剂。
(1)工业上可利用反应2Cl2(g)+NH3(g)![]() NHCl2 (l)+2HCl(g)制备二氯胺。
NHCl2 (l)+2HCl(g)制备二氯胺。
①二氯氨在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质,写出具有强杀菌作用的物质的电子式_______________________。
②在恒温条件下,将2molCl2和1molNH3充入某密闭容器中发生上述反应,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示。则A、B、C三点中Cl2转化率最高的是________点( 填“A” “B”或“C”);计算C点时该反应的压强平衡常数Kp(C)=_____________(Kp是平衡分压代替平衡浓度计算,分压= 总压×物质的量分数。)

(2)用Cl2和NH3反应制备三氯胺的方程式为3Cl2(g)+NH3(g)![]() NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t /min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(Cl2)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①T℃__________400℃(填“>”或“<”)。
②该反应的ΔH__________0(填“>”或“<”)。
③该反应自发进行的条件是__________(填高温、低温、任何温度)。
④对该反应,下列说法正确的是_________(填选项字母)。
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内Cl2和NH3物质的量之比为3∶1,则表明反应达到平衡状态
C.反应达到平衡后,其他条件不变,在原容器中按![]() =
=![]() 继续充入一定量反应物,达新平衡后Cl2的转化率增大
继续充入一定量反应物,达新平衡后Cl2的转化率增大
D.反应达到平衡后,其他条件不变,加入一定量的NC13,平衡将向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)一定温度下,在容积固定的密闭容器中进行的可逆反应:2NO2![]() 2NO+O2,达到平衡的标志是
2NO+O2,达到平衡的标志是
①相同时间内,氧气的生成速率为n mol·L-1·s-1,NO2的生成速率为2n mol·L-1·s-1
②单位时间内生成n mol O2的同时生成2n mol的NO
③混合气体的颜色不再变化 ④混合气体的密度保持不变
⑤混合气体的平均相对分子质量不再改变 ⑥压强不随时间变化而变化
A. ①③⑤⑥ B. ②③⑤
C. ①③④ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 铝合金是一种混合物,它比纯铝的熔点高
B. 电解熔融三氯化铝可生产金属金属铝
C. 水晶项链和餐桌上的瓷盘都是硅酸盐制品
D. 铜具有良好的导电性,常用来制作印刷电路板
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铅(PbO)是黄色固体。实验室用草酸在浓硫酸作用下分解制备CO,其原理为:H2C2O4![]() CO↑+CO2↑+H2O。某课题组同学设计实验探究CO还原氧化铅并检验氧化产物(已知CO能使银氨溶液产生黑色沉淀)的装置如图所示。下列说法正确的是
CO↑+CO2↑+H2O。某课题组同学设计实验探究CO还原氧化铅并检验氧化产物(已知CO能使银氨溶液产生黑色沉淀)的装置如图所示。下列说法正确的是

A. 实验时,先点燃装置①处酒精灯,当装置⑤中产生连续气泡且有明显现象后再点燃装置③处酒精灯
B. 实验完毕时,先熄灭装置①处酒精灯,再熄灭装置③处酒精灯
C. 装置②④⑤中的试剂依次为碱石灰、银氨溶液、澄清石灰水
D. 尾气处理可选用点燃、气袋收集、NaOH溶液吸收等方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(8分).氮化硅(Si3N4)是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定,工业上普遍采用高纯硅与纯氮在1300℃反应获得。
(1)根据性质,推测氮化硅陶瓷的用途是 。
A.制汽轮机叶片 | B.制有色玻璃 | C.制永久性模具 | D.制造柴油机 |
(2)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,她不与其他无机酸反应。试推测该陶瓷被氢氟酸腐蚀的化学方程式为 。
(3)现用四氯化硅和氮气在氢气中加强热发生反应,可制得高纯度氮化硅,反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上生产玻璃的原料是___________ 、_____________ 、_______________;有关的反应原理有:__________________________________、_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A的相对分子质量为84。回答下列问题:
(1)烃A的分子式为_________。
(2)下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量不变的是_____;若总质量一定,充分燃烧消耗氧气的量不变的是____。
A. C7H8 B.C6H14 C.C7H14 D.C8H8
(3)若烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种。
①A的结构简式为__________。
②链烃A与Br2的CCl4溶液反应生成B,写出由A生成B的化学方程式:_________
③与A互为同分异构体,且主链碳原子个数与A相同的链烃有_____种(不包括A)
(4)若A不能使溴水褪色,且其一氯代物只有一种,则A的所有碳原子是否在同一平面上__________。(是 否)
(5)如图:
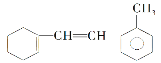
①该物质与足量氢气完全加成后环上一氯代物有________种;
②该物质和溴水混合,耗Br2的物质的量为_______mol;
③该物质和H2加成需H2________mol;判断下列说法不对的有________。
A.此物质可发生加成、取代、氧化等反应,不能发生加聚反应
B.和甲苯属于同系物
C.使溴褪色的原理与乙烯相同
D.能使酸性KMnO4溶液褪色是发生的加成反应
(6)按下列要求,回答问题:
如图是辛烷的一种结构M(只画出了碳架,没有画出氢原子),回答下列问题:
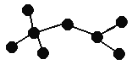
①用系统命名法命名________。
②M的二氯代物有________种。
③M是由某烯烃加成生成的产物,则该烯烃可能有_______种结构。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com