
肼(H2N—NH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1 mol 化学键所需的能量(kJ):N≡N 为942、O=O为500、N—N为154,则断裂1 mol N—H 键所需的能量(kJ)是 ( )。

A.194 B.391
C.516 D.685
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
结合金属晶体的结构和性质,回答以下问题:
(1)根据下列叙述,判断一定为金属晶体的是________。
A.由分子间作用力形成,熔点很低
B.由共价键结合形成网状晶体,熔点很高
C.固体有良好的导电性、传热性和延展性
(2)下列关于金属晶体的叙述正确的是________。
A.常温下,金属单质都以金属晶体形式存在
B.金属阳离子与自由电子之间的强烈作用,在一定外力作用下,不因形变
而消失
C.钙的熔、沸点高于钾
D.温度越高,金属的导电性越好
查看答案和解析>>
科目:高中化学 来源: 题型:
碘水在水中的溶解度很小,但易溶于KI溶液,因为发生反应:I2(aq)+I-(aq)I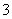 (aq)。测得不同温度下该反应的平衡常数如下表所示:
(aq)。测得不同温度下该反应的平衡常数如下表所示:
| T/℃ | 3.8 | 15.3 | 25.0 | 35.0 | 50.2 |
| K | 1 160 | 841 | 689 | 533 | 409 |
下列说法不正确的是 ( )。
A.上述反应的正反应为放热反应
B.实验室配制碘水,为增大碘的溶解度可加入少量的KI
C.用该反应原理可除去硫粉中少量的碘单质
D.向上述体系中加入苯,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
有一反应:2A+B2C,其中A、B、C均为气体,右图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是 ( )。
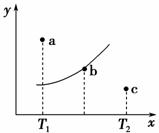
A.该反应是放热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1温度下a点表示若想达到平衡,可以采取增大压强的方法
D.c点可表示v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上由 CO2 和 H2 合成气态甲醇的热化学方程式为:CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=-50 kJ·mol-1。下面表示合成甲醇的反应的能量变化示意图,其中正确的是 ( )。
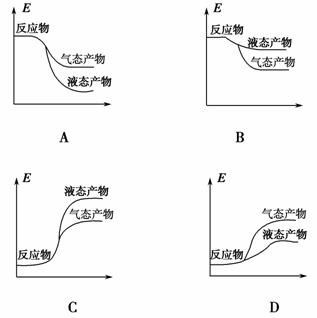
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)。反应过程中的能量关系可用右图简单表示(图中的ΔH表示生成
1 mol产物的数据)。

(1)写出表示S8燃烧热的热化学方程式________________________________
________________________________________________________________。
(2)写出SO3分解生成SO2和O2的热化学方程式_________________________
_________________________________________________________________。
(3)若已知1个S8分子中有8个硫硫键,硫氧键的键能为d kJ·mol-1,氧氧键的键能为e kJ·mol-1,则S8分子中硫硫键的键能为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
发射“神六”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知:N2(g)+2O2(g)===2NO2(g)
ΔH=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g)
ΔH=-534 kJ·mol-1
下列关于肼和NO2反应的热化学方程式中,正确的是 ( )。
A.2N2H4(g)+2NO2(g)===3N2(g)+4H2O(l)
ΔH=-1 135.7 kJ·mol-1
B.2N2H4(g)+2NO2(g)===3N2(g)+4H2O(g)
ΔH=-1 000.3 kJ·mol-1
C.N2H4(g)+NO2(g)===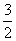 N2(g)+2H2O(l)
N2(g)+2H2O(l)
ΔH=-500.15 kJ·mol-1
D.2N2H4(g)+2NO2(g)===3N2(g)+4H2O(g)
ΔH=-1 135.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
用选项中的电极、溶液和如图所示装置可组成原电池。下列现象或结论的叙述正确的是 ( )。

| 选项 | 电极a | 电极b | A溶液 | B溶液 | 现象或结论 |
| A | Cu | Zn | CuSO4 | ZnSO4 | 一段时间后,a增加的质量与b减少的质量相等 |
| B | Cu | Zn | 稀 H2SO4 | ZnSO4 | 盐桥中阳离子向b极移动 |
| C | Fe | C | NaCl | FeCl3 | 外电路电子转移方向:b→a |
| D | C | C | FeCl3 | KI、淀粉 混合液 | 若开始时只增大FeCl3溶液浓度,b极附近溶液变蓝的速度加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
能够说明一个可逆反应H2(g)+I2(g)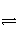
 2HI(g)已达到平衡状态的是( )
2HI(g)已达到平衡状态的是( )
A.1 mol H—H键断裂的同时有1 mol H—I键形成
B.1 mol H—H键断裂的同时有2 mol H—I键形成
C.1 mol I—I键断裂的同时有2 mol HI键形成
D.1 mol H—H键断裂的同时有1 mol I—I键形成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com