
【题目】有下列粒子:
①CH4 ②CH2 ===CH2 ③CH≡CH ④NH3 ⑤NH4 + ⑥BF3 ⑦H2O
填写下列空白(填序号):
(1)呈正四面体的是_____。
(2)中心原子轨道为 sp3 杂化的是_____,为 sp2 杂化的是_____,为 sp 杂化的是_____。
(3)所有原子共平面的是_____,共线的是_____。
(4)粒子存在配位键的是_____。
(5)含有极性键的极性分子的是_____。
【答案】①⑤ ①④⑤⑦⑧ ②⑥ ③ ②③⑥ ③ ⑤ ④⑦
【解析】
根据价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=![]() (a-xb),依据杂化轨道数判断杂化类型判断微粒的构型来解答(1)~(3);
(a-xb),依据杂化轨道数判断杂化类型判断微粒的构型来解答(1)~(3);
(4)判断分子中能否有提供孤电子对和空轨道的粒子,以此来解答;
(5)同种元素之间形成非极性共价键,不同元素之间形成极性共价键,分子中正负电荷中心不重合的为极性分子;正负电荷的重心重合的为非极性分子,据此判断。
①CH4中C原子杂化轨道数=δ键数+孤对电子对数=4+0=4,所以采取sp3杂化,空间构型为正四面体结构;
②CH2 =CH2中C原子杂化轨道数=δ键数+孤对电子对数=3+0=3,所以采取sp2杂化,空间构型为平面形分子;
③CH≡CH中C原子杂化轨道数=δ键数+孤对电子对数=2+0=2,所以采取sp杂化,空间构型为直线形分子;
④NH3中氮原子杂化轨道数=δ键数+孤对电子对数=3+1=4,所以采取sp3杂化,空间构型为三角锥形分子;
⑤NH4+中氮原子杂化轨道数=δ键数+孤对电子对数=4+0=4,所以采取sp3杂化,空间构型为正四面体结构;
⑥BF3中B原子杂化轨道数=δ键数+孤对电子对数=3+0=3,所以采取sp2杂化,空间构型为平面三角形分子;
⑦H2O中O原子杂化轨道数=δ键数+孤对电子对数=2+2=4,所以采取sp3杂化,空间构型为V形分子;
(1)根据上述分析,呈正四面体的有①⑤,故答案为:①⑤;
(2) 根据上述分析,中心原子轨道为 sp3 杂化的有①④⑤⑦⑧,中心原子轨道为sp2杂化的是②⑥;为sp杂化的是③,故答案为:①④⑤⑦;②⑥;③;
(3)①CH4是正四面体结构,所有原子不共面也不共线;②C2H4是平面形分子,所有原子共平面但不共线;③CH≡CH是直线形分子,所有原子共平面也共线;④NH3是三角锥形分子,所有原子不共面也不共线;⑤NH4+是正四面体结构,所有原子不共面也不共线;⑥BF3是平面三角形分子,所有原子共平面但不共线;⑦H2O是V形分子,所有原子共平面但不共线;所有原子共平面的是②③⑥,共线的是③,故答案为:②③⑥;③;
(4)NH4+中N提供孤电子对,H+提供空轨道,二者都能形成配位键,其余都不能形成配位键,故答案为:⑤;
(5)①CH4为正四面体结构,分子中含有C-H极性键,正负电荷的重心重合,为非极性分子;②CH2═CH2为平面结构,含C=C、C-H键,正负电荷的重心重合,为非极性分子;③CH≡CH为直线结构,含C≡C、C-H键,正负电荷的重心重合,为非极性分子;④NH3为三角锥型,只含N-H键,电荷的分布是不均匀的,为极性分子;⑤NH4+为正四面体结构,只含N-H键,正负电荷的重心重合,为非极性的离子;⑥BF3为平面三角形分子,分子中含有B-F极性键,正负电荷的重心重合,为非极性分子;⑦H2O分子中含有O-H极性键,是V形分子,电荷的分布是不均匀的,为极性分子;含有极性键的极性分子的是④⑦,故答案为:④⑦。


科目:高中化学 来源: 题型:
【题目】拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂。虽然是一种“农药”,但它不仅在田间地头,在我们百姓家庭中也随处可见,如蚊香等。下图所示是一种拟除虫菊酯——溴氰酯的结构简式:
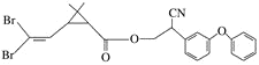

下列对该化合物的叙述中,正确的是( )
A.含有羧基B.可使酸性KMnO4溶液褪色
C.不能燃烧D.该化合物含有苯环,属于烃
查看答案和解析>>
科目:高中化学 来源: 题型:
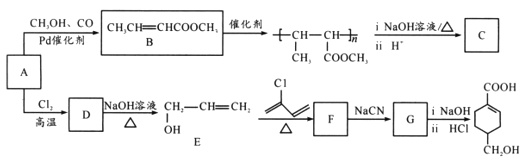
【题目】A(C3H6)是基本有机化工原料,由A制备聚合物C和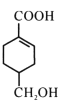 合成路线如图所示(部分条件略去)。
合成路线如图所示(部分条件略去)。
已知: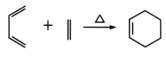 ,
,![]() RCOOH
RCOOH
(1) 发生缩聚形成的高聚物的结构简式为____;D→E的反应类型为____。
发生缩聚形成的高聚物的结构简式为____;D→E的反应类型为____。
(2)E→F的化学方程式为____。
(3)B的同分异构体中,与B具有相同官能团且能发生银镜反应,其中核磁共振氢谱上显示3组峰,且峰面积之比为6:1:1的是____(写出结构简式)。
(4)等物质的量的 分别与足量NaOH、NaHCO3反应, 消耗NaOH、NaHCO3的物质的量之比为____;检验
分别与足量NaOH、NaHCO3反应, 消耗NaOH、NaHCO3的物质的量之比为____;检验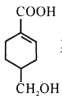 的碳碳双键的方法是____(写出对应试剂及现象)。
的碳碳双键的方法是____(写出对应试剂及现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃与氢气混合在常温常压时不反应,高温时反应很慢,但在适当的催化剂存在时可与氢气反应生成烷烃,一般认为加氢反应是在催化剂表面上进行。反应过程的示意图如图:

下列说法正确的是( )
A.乙烯和H2生成乙烷反应的△H>0
B.有催化剂时的活化能E2比无催化剂时的活化能E1低,不能减小反应的△H
C.催化加氢过程中金属氢化物的一个氢原子和双键碳原子先结合,得到中间体
D.催化加氢过程中催化剂将较难发生的反应分成了多个容易发生的反应,可提高反应物的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应H2(g)+I2(g)![]() 2HI(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
2HI(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内断裂nmolH—H键的同时形成2nmolH—I键
②单位时间内生成nmolI2的同时生成2nmolHI
③2v正(H2)=v逆(HI)
④HI分子数不再改变
⑤混合气体颜色不再改变
⑥混合气体压强不再改变
A.②④⑤⑥B.②③④⑤C.①③④⑤D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据化学能和热能、电能相关的知识,请回答下列问题:
I.已知31 g白磷(P4)变为31 g红磷(P)时释放能量。上述变化属于_____变化;稳定性白磷_____红磷(填“>”或“<”);
II.氢气是一种清洁能源,在我国航天工程中也有应用。
(1)已知:2H2+O2![]() 2H2O。该反应1g氢气完全燃烧放出热量121kJ,其中断裂1molH—H键吸收436kJ,断裂1molO=O键吸收496kJ,那么形成1molH—O键放出热量_______________。
2H2O。该反应1g氢气完全燃烧放出热量121kJ,其中断裂1molH—H键吸收436kJ,断裂1molO=O键吸收496kJ,那么形成1molH—O键放出热量_______________。
(2)航天技术上使用的氢-氧燃料电池原理可以简单看作下图“氢-氧燃料电池的装置图” 则:

①a极为电池的______(填“正极”或“负极”);溶液中OH-移向_______电极(填“a”或“b”)。
②b电极附近pH_______。(填增大、减小或不变)。
③如把H2改为甲烷,则电极反应式为:负极_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. NO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B. P4和CH4都是正四面体形分子且键角都为109°28′
C. NH4+的电子式为 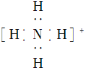 ,离子呈平面正方形结构
,离子呈平面正方形结构
D. NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写不正确的是( )
A.钠与水反应:Na+H2O=Na++OH-+H2↑
B.氯化钡溶液与稀硫酸反应:Ba2++SO![]() =BaSO4↓
=BaSO4↓
C.碳酸钠溶液与足量盐酸反应:CO![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
D.铜与稀硝酸反应:3Cu+8H++2NO![]() =3Cu2++2NO↑+4H2O
=3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
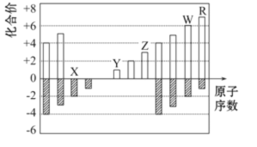
A.原子半径:Z>Y>X
B.气态氢化物稳定性:R<W
C.WX3和水反应生成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com