
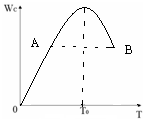
 对于反应2A(g)+B(g)?2C(g)在反应过程中C的质量分WC随温度变化如图所示,试确定:
对于反应2A(g)+B(g)?2C(g)在反应过程中C的质量分WC随温度变化如图所示,试确定:分析 (1)由图可知,温度T0前,C的质量分数增大,故未达平衡,反应向正反应进行,温度T0后,C的质量分数减小,平衡向逆反应进行,故温度T0时,反应到达平衡状态;
(2)A、B两点,各组分的浓度相同,温度越高反应速率越快;
(3)反应还没有到达平衡,反应正向进行,随着温度升高,生成的C越来越多;
(4)根据平衡时各物质的浓度幂之积,与平衡常数相比较比较可得到正逆反应速率的大小关系.
解答 解:(1)由图可知,温度T0前,C的质量分数增大,故未达平衡,反应向正反应进行,温度T0后,C的质量分数减小,平衡向逆反应进行,故温度T0时,反应到达平衡状态,故V正=V逆,
故答案为:=;
(2)A、B两点,各组分的浓度相同,温度越高反应速率越快,故VA<VB,
故答案为:<;
(3)温度T0前,反应还没有到达平衡,反应向正反应进行,随着温度升高,生成的C越来越多,
故答案为:反应还没有到达平衡,反应向正反应进行,随着温度升高,生成的C越来越多;
(4)测得某时刻,A(g)、B(g)、C(g)的浓度均为0.5mol/L,则$\frac{0.{5}^{2}}{0.5×0.5}$=1<2.33,则平衡正向移动,正反应速率大于逆反应速率.
故答案为:>.
点评 本题考查化学平衡图象、影响化学平衡的因素等,为高频考点,难度中等,关键根据C的质量分数判断温度T0前未达平衡,从T0后为平衡状态.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol | B. | 3mol | C. | 4mol | D. | 6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| 总压强p/100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁制品的腐蚀常以析氢腐蚀为主 | |
| B. | 厨房中常用碳酸钠溶液洗涤餐具上的油污 | |
| C. | 明矾[KAl(SO4)2•12H2O]用于水的杀菌消毒 | |
| D. | 新型材料聚酯纤维、光导纤维都属于有机高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
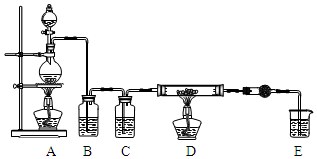 无水AlCl3是一种重要的化工原料.某课外探究小组尝试制取无水AlCl3,查阅资料获得下列信息:无水AlCl3在178℃升华,极易潮解,遇水蒸气产生白色烟雾.
无水AlCl3是一种重要的化工原料.某课外探究小组尝试制取无水AlCl3,查阅资料获得下列信息:无水AlCl3在178℃升华,极易潮解,遇水蒸气产生白色烟雾.| 第一次实验 | 第二次实验 | 第三次实验 | |
| D中固体用量 | 2.0g | 2.0g | 2.0g |
| 氢气的体积 | 334.5mL | 336.0mL | 337.5mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为 2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.3kJ•mol-1 | |
| D. | 500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | H2C2O4溶液 | KMnO4溶液 | 温度 |
| Ⅰ | 20mL 0.2mol•L-1 | 30mL 0.01mol•L-1 | 25℃ |
| Ⅱ | 20mL 0.1mol•L-1 | 30mL 0.01mol•L-1 | 25℃ |
| Ⅲ | 20mL 0.2mol•L-1 | 30mL 0.01mol•L-1 | 50℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com