
【题目】随着原子序数的递増,八种短周期元素(用字母x、y、z…表示)的原子半径的相对大小、最高正价或最低负价的变化如下图所示。请根据判断出的元素回答下列问题

(1)f在元素周期表中的位置是第三周期第____族。
(2)比较d、e常见离子的半径大小:_______(用化学符号表示且用“>”连接,下同)。比较g、h的最高价氧化物对应的水化物的酸性强弱:_______
(3)写出x与z形成的常见四原子共价化合物的电子式_______
(4)物质A是一种常用的比水轻的有机溶剂,其仅由x、y两种元素组成,且y元素与x元素的质量比为12:1,A的相对分子质量为78。A与浓硫酸、浓硝酸在50~60℃下发生反应的化学方程式为__________,反应类型为__________。
(5)f的最高价氧化物对应的水化物可以与e的最高价氧化物对应的水化物反应,请写出该反应的离子方程式:_______________。
【答案】ⅢA O2->Na+ HClO4>H2SO4 ![]()
 取代反应 Al(OH)3 +OH- = AlO2- + 2H2O
取代反应 Al(OH)3 +OH- = AlO2- + 2H2O
【解析】
从图中的化合价和原子半径的大小,可以推出x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素,据此回答各题。
(1) f是Al元素,在元素周期表的位置是第三周期 ⅢA族;
(2) 电子层结构相同的离子,核电荷数越大离子半径越小,故r(O2-)>r(Na+);非金属性越强,最高价氧化物水化物的酸性越强,故HClO4>H2SO4;
(3) 四原子共价化合物是NH3其电子式为: ![]() ;
;
(4) y元素与x元素的质量比为12:1,可推知![]() 所以A的最简式为CH, 又根据A的相对分子质量为78,可推知A的分子式为C6H6,A是一种常用的比水轻的有机溶剂,可知A是苯,结构简式为:
所以A的最简式为CH, 又根据A的相对分子质量为78,可推知A的分子式为C6H6,A是一种常用的比水轻的有机溶剂,可知A是苯,结构简式为:![]() 。A与浓硫酸、浓硝酸在50~60℃下发生反应的化学方程式为
。A与浓硫酸、浓硝酸在50~60℃下发生反应的化学方程式为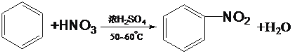 ,反应类型为取代反应;
,反应类型为取代反应;
(5) f的最高价氧化物对应的水化物为Al(OH)3,e的最高价氧化物对应的水化物为NaOH,该反应的离子方程式:Al(OH)3 + OH- = AlO2- + 2H2O。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】已知:①![]() ;
;
② 苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。
以下是用苯作原料制备一系列化合物的转化关系图:

(1)A转化为B的化学方程式是_________________________。
(2)图中“苯→①→②”省略了反应条件,请写出①、②物质的结构简式:
①________________,②____________________。
(3)苯的二氯代物有__________种同分异构体。
(4)有机物 的所有原子_______(填“是”或“不是”)在同一平面上。
的所有原子_______(填“是”或“不是”)在同一平面上。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某体系内有反应物和生成物5种物质:FeCl3、FeCl2、H2S、S、HCl,已知FeCl2为生成物,则另一生成物是
A. FeCl3 B. H2S C. S D. HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如果M、SO42-、Mg2+和Na+四种离子以物质的量之比为2∶4∶1∶2共同存在于同一种溶液中,那么M可能是
A. Ba2+ B. CO32- C. Cu2+ D. Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水里可以提取溴,主要反应为2Br﹣+Cl2=2Cl﹣+Br2,下列说法正确的是( )
A.溴离子具有氧化性B.氯气是还原剂
C.该反应属于复分解反应D.Br2是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)结合表中给出的电离平衡常数回答下列问题:
酸或碱 | CH3COOH | HNO2 | HCN | HClO |
电离平衡常数(Ka或Kb) | 1.8×10-5 | 4.6×10-4 | 5×10-10 | 3×10-8 |
①上述四种酸中,酸性最弱、最强的酸分别是_______、_______(用化学式表示)。
②下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是____(填序号)。
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体
D.加少量冰醋酸 E.加氢氧化钠固体
③依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式___________________________________。
(2) 某学习小组利用酸性KMnO4和H2C2O4反应来探究“外界条件对化学反应速率的影响”。 实验时,先分别量取KMnO4酸性溶液、H2C2O4溶液,然后倒入大试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。
①已知草酸H2C2O4是一种二元弱酸,写出草酸的电离方程式__________、___________。酸性KMnO4溶液和H2C2O4溶液反应的离子方程式为:_____________________________
某同学设计了如下实验
实验编号 | H2C2O4溶液 | KMnO4溶液 | 温度/℃ | ||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | ||
a | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
b | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
c | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
②探究浓度对化学反应速率影响的组合实验编号是__________,可探究温度对化学反应速率影响的实验编号是__________。
③实验a测得混合后溶液褪色的时间为40 s,忽略混合前后体积的微小变化,则这段时间内的平均反应速率v(KMnO4)=______ mol·L-1·min-1。
④在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,褪色总是先慢后快,其可能的原因是___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在1L恒容密闭容器中加入lmol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
时间(min) | 0 | t1 | t2 | t3 |
NH3物质的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
A. 0t1min,v(NH3)=0.2/t1mol·L-1·min-1
B. t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol·L-1
C. N2(g)+3H2(g) ![]() 2NH3(g)的活化能小于2NH3(g)
2NH3(g)的活化能小于2NH3(g) ![]() N2(g)+3H2(g)的活化能
N2(g)+3H2(g)的活化能
D. 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯腈(CH2===CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2===CHCHO)和乙腈(CH3CN)等。回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
①C3H6(g)+NH3(g)+3/2O2(g)===C3H3N(g)+3H2O(g)ΔH=-515 kJ·mol-1
②C3H6(g)+O2(g)===C3H4O(g)+H2O(g)ΔH=-353 kJ·mol-1
有利于提高丙烯腈平衡产率的反应条件是__________;提高丙烯腈反应选择性的关键因素是________。
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460 ℃。低于460 ℃时,丙烯腈的产率____(填“是”或“不是”)对应温度下的平衡产率,判断理由是________________;高于460 ℃时,丙烯腈产率降低的可能原因是________(双选,填标号)。
A.催化剂活性降低 B.平衡常数变大
C.副反应增多 D.反应活化能增大

(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示。由图可知,最佳n(氨)/n(丙烯)约为_____,理由是______________________________。进料气氨、空气、丙烯的理论体积比约为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是现行中学化学教科书中元素周期表的一部分,除标出的元素外。表中的每个编号表示一种元素,请根据要求回答问题:
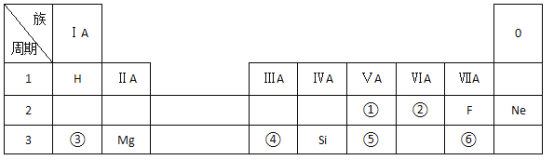
(1)②表示的元素是____________(填元素符号)。
(2)①与⑤两种元素相比较,原子半径较大的是 ______(填元素符号);其非金属性较强的是 ______(填元素符号);其最高正价氧化物水化物酸性较强的酸是_____(填分子式)。
(3)⑥元素的单质可以用来制取漂白粉,其有效成分是______(填化学式)。
③与⑥两种元素所形成化合物的电子式是____________。
(4)写出元素③的最高价氧化物对应的水化物与元素④的最高价氧化物对应的水化物相互反应的化学方程式________________________。
(5)②与⑥元素的氢化物的稳定性 ______大于______(填分子式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com