
| A. | H2和CO2 | B. | CO2和H2O | C. | CO和CH3OH | D. | CH3OH和H2 |
分析 根据“绿色化学工艺”的特征:反应物中原子全部转化为欲制得的产物,即原子的利用率为100%;即生成物质只有一种,由原子守恒推测反应物的种类.
解答 解:原子利用率为100%,即反应物全部转化为最终产物.用CH3C≡CH合成CH2═C(CH3)COOCH3,即要把一个C3H4分子变成一个C5H8O2分子,还必须增加2个C原子、4个H原子、2个O原子,即原料中另外的物质中C、H、O的原子个数比为1:2:1.
A.CO2和H2,两种物质分子里三种原子不论怎样组合也都不能使C、H、O的原子个数比为1:2:1,故A错误;
B.CO2和H2O,两种物质分子里三种原子不论怎样组合都不能使C、H、O的原子个数比为1:2:1,故B错误;
C.CO和CH3OH,两种物质如果按照分子个数比1:1组合,则C、H、O的原子个数比为1:2:1,故C正确;
D.H2和CH3OH,两种物质分子里三种原子不论怎样组合也都不能使C、H、O的原子个数比为1:2:1,故D错误;
故选C.
点评 本题考查绿色化学的特征,难度中等.抓住“绿色化学工艺”中反应物中原子全部转化为欲制得的产物,即原子的利用率为100%是解答本题的关键.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L的己烷所含的分子数为0.5 NA 个 | |
| B. | 28 g乙烯所含共用电子对数目为6 NA个 | |
| C. | 标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA个 | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为6 NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.26 t | B. | 1.98 t | C. | 1.65 t | D. | 1.06 t |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②③ | B. | 只有③④ | C. | ①②③④ | D. | 只有①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
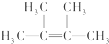 ;名称是2,3-二甲基-2-丁烯.
;名称是2,3-二甲基-2-丁烯. .
.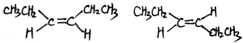 、(CH3CH2)2C=CH2.
、(CH3CH2)2C=CH2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只能是7 | B. | 只能是15 | C. | 是11或15 | D. | 是11或13 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
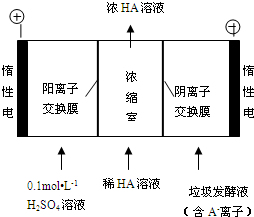
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
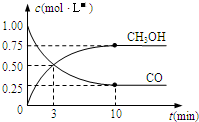 CO的应用和治理是当今社会的热点问题.
CO的应用和治理是当今社会的热点问题.| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com