
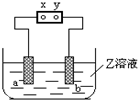
 图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的( )
图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的( )| a极板 | b极析 | X电极 | Z溶液 | |
| A | 锌 | 石墨 | 负极 | CuSO4 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 银 | 铁 | 负极 | AgNO3 |
| D | 铜 | 石墨 | 负极 | CuCl2 |
| A. | A | B. | B | C. | D |
分析 先根据题意判断a、b、x、y电极名称,发现a极板质量增加,则a极析出金属,a极为阴极,b极板处有无色无臭气体放出,b极为阳极,所以x为负极,y为正极,根据溶液中得失电子判断电解质溶液的成分及电极材料,分析判断.
解答 解:通电后发现a极板质量增加,所以金属阳离子在a极上得电子,a极是阴极;b极是阳极,b极板处有无色无臭气体放出,即溶液中氢氧根离子放电生成氧气,电极材料必须是不活泼的非金属,所以X为负极,Y为正极,
A、Zn作阴极,石墨为阳极,阴极上铜离子得电子生成Cu,阳极上氢氧根离子失电子生成氧气,故A正确;
B、电解氢氧化钠溶液在两极上分别得到氧气和氢气,得不到金属单质,故B错误;
C、铁是活泼金属,作阳极失电子,所以在b极上得不到气体,故C正错误;
D、电解质溶液中氯离子失电子,在b极上得到有刺激性气味的气体,与题意不符,故D错误.
故选A.
点评 本题考查了电解池工作原理,明确溶液中离子的放电顺序是解本题的关键,解题时还要注意正极的电极材料,如果是较活泼的金属,电极材料失电子,不是溶液中离子失电子,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 给定条件的有机化合物 | 同分异构体数目 |
| A | 分子式为C4H9Cl的有机物 | 3种 |
| B | 分子式为C5H10O2的一元酯 | 8种 |
| C | 分子式为C5H10的环烷烃 | 3种 |
| D | 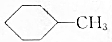 的一溴代物 的一溴代物 | 5种 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解、蒸发 | B. | 萃取、蒸馏 | C. | 分液、蒸馏 | D. | 萃取、过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 2.0 | 3.0 | 3.0 | 2.0 | 5.2 |
| 3 | 1.0 | 4.0 | 3.0 | 2.0 | 6.4 |
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 切开的金属Na暴露在空气中,光亮的表面逐渐变暗2Na+O2═Na2O2 | |
| B. | 某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀 SO42-+Ba2+═BaSO4↓ | |
| C. | Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2Na2O2+CO2═2Na2CO3+O2 | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 丙烷 | B. | 乙烷 | C. | 丙烯 | D. | 甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 把t2℃时的MgSO4饱和溶液的温度升高,溶液仍然饱和 | |
| B. | 将t3℃时的MgSO4饱和溶液的温度降低,有晶体析出 | |
| C. | t2℃时,饱和溶液的溶质物质的量浓度:MgSO4比NaCl大 | |
| D. | 分别将t1℃时MgSO4饱和溶液、NaCl饱和溶液的温度升高到t2℃,所得溶液的溶质质量分数前者更大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
| C | 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
| D | 室温下其单质为淡黄色粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| E | 它在地壳中储量丰富,是人体不可缺少的微量元素之一.其单质为银白色固体,是工农业生产中不可或缺的金属材料,常用于机械制备、建筑等行业 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com