
| A. | 灼热的炭与氧气碳反 应 | |
| B. | 铁和稀硫酸的反应 | |
| C. | 氢氧化钡晶体的粉末和氯化铵晶体混合 | |
| D. | 钢铁制品生锈的反应 |
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验及现象 | 结论 |
| A | 向AgNO3和AgCl的浊液中滴入0.1mol/LNa2S溶液,生成黑色沉淀 | Ag2S的溶度积比AgCl的小 |
| B | 将光亮镁条放入盛有NH4Cl溶液的试管中,产生大量气泡,同时将湿润的红色石蕊试纸靠近试管口,试纸变蓝 | 反应产生的气体一定是NH3 |
| C | 向溶液X中先滴加稀硝酸,在滴加Ba(NO3)2溶液,出现白色沉淀 | 溶液X中一定含有SO42- |
| D | 将铜粉加入1.0mol/L Fe2(SO4)3溶液中,溶液变蓝 | 说明氧化性Fe3+>Cu2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
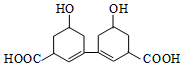 中国是中草药的发源地,目前中国大约有12000种药用植物.从某中草药提取的有机物结构如图所示,该有机物的下列说法中错误的是( )
中国是中草药的发源地,目前中国大约有12000种药用植物.从某中草药提取的有机物结构如图所示,该有机物的下列说法中错误的是( )| A. | 该物质的熔点比同碳的烃分子熔点高 | |
| B. | 分子式为C14H18O4 | |
| C. | 1mol该有机物与足量的金属钠反应产生4molH2 | |
| D. | 环上氢原子的一氯取代物5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下0.1 mol/L NaHSO3溶液中HSO3-电离程度大于水解程度 | |
| B. | 当加入的Ba(OH)2溶液体积小于5 mL时,溶液中的反应为:2HSO3-+Ba2++2OH-?BaSO3↓+2H2O+SO32- | |
| C. | 滴加过程中,溶液中白色沉淀不断增加 | |
| D. | 当加入Ba(OH)2溶液体积为7.5 mL时,溶液中离子浓度大小为:c(Na+)>c(SO32-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铝片和硫酸反应制氢气,硫酸浓度越高,反应速率越快 | |
| B. | 锌和稀硫酸反应制氢气时,加入少量CuSO4溶液,可加快反应速率 | |
| C. | 增大压强、升高温度和使用催化剂均一定使反应速率加快 | |
| D. | 在碳酸钙和盐酸反应中,加多些碳酸钙可使反应速率明显如快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 操作方法 |
| A | 除去溴苯中的溴 | 将混合物倒入分液漏斗中,加入苯,充分振荡,静置,分液 |
| B | 制备氢氧化铁胶体 | 在氢氧化钠溶液中加入饱和FeCl3溶液,煮沸 |
| C | 除去Cl2中少量HCl | 将混合气体通过盛有饱和碳酸氢钠溶液的洗气瓶 |
| D | 验证CH3COONa溶液中存在水解平衡 | 取CH3COONa溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固体(其水溶液呈中性),观察溶液颜色变化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
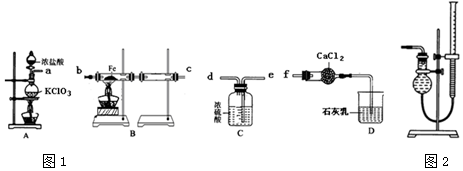
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用Cu+2FeCl3=CuCl2+2FeCl2反应,设计一个原电池并写出电极反应式画出示意图.
利用Cu+2FeCl3=CuCl2+2FeCl2反应,设计一个原电池并写出电极反应式画出示意图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com