
海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)多级闪蒸法是目前“海水淡化”的主要技术。该法是在一定条件下将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水。由此可判断多级闪蒸法是 (填“物理变化” 或“化学变化”)。
(2)利用海水晒盐的原理是 ;分离食盐晶体后的母液中含有KCl、MgCl2,经过分离、提纯后,可用于 。
(3)“氯碱工业”利用电解饱和食盐水制得重要化工产品。在氯碱工业中,隔膜法电解(如图甲所示)工艺逐渐被离子交换膜电解(如图乙所示)技术取代。
①写出两电极的反应式:阳极 ,阴极 。
②石棉隔膜的作用是 。离子交换膜电解槽中⑥、⑦分别是 、 。
科目:高中化学 来源: 题型:
铜粉放入稀硫酸中,加热后无明显现象发生。当加入下列一种物质后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出,该物质是( )
A.Al2(SO4)3 B.Na2CO3 C.KNO3 D.FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中发生如下反应:mA(g)+nB(g)  pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是 ( )
pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是 ( )
A. 平衡向逆反应方向移动 B. A的转化率降低 C. m+n>p D.C的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
对金属制品进行抗腐蚀处理,可延长其使用寿命。
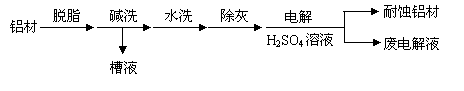 (1)以下为铝材表面处理的一种方法:
(1)以下为铝材表面处理的一种方法:
① 碱洗的目的是除去铝材表面的自然氧化膜,为将碱洗槽液中铝以沉淀形式回收,最好向槽液中加入下列试剂中的 。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4 溶液中电解,铝材表面形成氧化膜,阳极电极反应为
。取少量废电解液,加入NaHCO3,溶液后产生气泡和白色沉淀,产生沉淀的原因是 。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是 。
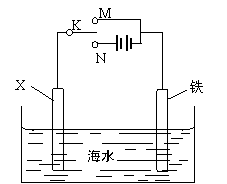
(3)利用下图装置,可以模拟铁的电化学防护。
若X为碳棒,为减缓铁的腐蚀,开关K应置于 处。若X为锌,开关K置于 处。
查看答案和解析>>
科目:高中化学 来源: 题型:
储氢合金表面镀铜过程发生反应Cu2++2HCHO+4OH-=Cu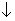 +H2
+H2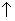 +2H2O+2HCOO-,下列说法错误的是
+2H2O+2HCOO-,下列说法错误的是
A.电镀过程中氢气在镀件表面析出
B.电镀时溶液中Cu2+移向阴极,并在阴极上发生还原反应
C.阳极反应式为HCHO+3OH--2e-=2H2O+HCOO-
D.电镀时每生成6.4g铜镀层放出2.24L H2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是
A.强电解质溶液的导电能力一定比弱电解质溶液的强
B.离子化合物中可能有共价键,共价化合物中肯定没有离子键
C.强电解质都是可溶性化合物,弱电解质都是难溶性化合物
D.NaCl晶体不导电是由于NaCl晶体中不存在离子
查看答案和解析>>
科目:高中化学 来源: 题型:
常温条件下,下列各组离子在指定溶液中能大量共存的是
A.使石蕊试液变红的溶液中:Fe2+、NO 、SO42—、Na+
、SO42—、Na+
B.由水电离出的c(H+)=1×10-14mol/L的溶液中:Ca2+、Cl-、HCO 、K+
、K+
C.c(H+)/c(OH-)=1×1012的溶液中:NH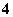 、Cl-、SO42—、Al3+
、Cl-、SO42—、Al3+
D.c(Al3+)=0.1 mol/L的溶液中:K+、Cl-、SO42—、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
(1) 写出氢氧燃料电池工作时正极电极反应方程式:_______
(2) 若将此燃料电池改为以肼( N2H4)和氧气为原料(其他条件不变),工作时(产物为N2 , H2O)负极电极反应式为______
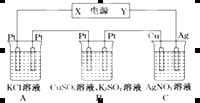
(3) 用上述氢氧燃料电池作直流电源进行电解,装置如下图所示。若通电5 min时,铜电极质量增加2.16 g。试回答:
① 电源中Y电极为直流电源的__________极。(填“正”或“负”)
② 通电5 min后B中pH变化:________,(填“增大”、“减小”或“不变”)。
③ 通电5 min时氢氧燃料电池中,理论上消耗标准状况下_______L氧气。
④ A中KCl溶液体积也是200 mL,通电5 min后,溶液的OH-浓度_______mol·L-1(设电解前后溶液体积无变化且KCl有剩余)。
⑤ 通电5 min时,B中共收集224 mL气体(标况),溶液体积为200 mL,则通电前CuSO4溶液的物质的量浓度为____________(设电解前后溶液体积无变化)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com