
| R | ||
| X | Y | Z |
| A. | 可用YO2+Z2+2H2O=H2YO4+2HZ,证明非金属性:Z>Y | |
| B. | 含有Z元素的钠盐溶液都呈中性 | |
| C. | 由非金属性Z>Y可知,最高价氧化物对应的水化物的氧化性:Z>Y | |
| D. | 最简单气态氢化物的热稳定性:R>X |
分析 由短周期元素R、X、Y、Z在元素周期表中的相对位置,Y原子的核外电子数是R的2倍,可知R为O,Y为S,结合位置可知X为P,Z为Cl,
A.YO2+Z2+2H2O=H2YO4+2HZ中,Cl得到电子,S失去电子;
B.NaCl为中性,NaClO溶液水解显碱性,硫酸氢钠电离显酸性;
C.非金属性越强,对应最高价氧化物对应的水化物的酸性越强;
D.非金属性越强,对应氢化物的稳定性越强.
解答 解:由短周期元素R、X、Y、Z在元素周期表中的相对位置,Y原子的核外电子数是R的2倍,可知R为O,Y为S,结合位置可知X为P,Z为Cl,
A.YO2+Z2+2H2O=H2YO4+2HZ中,Cl得到电子,S失去电子,但不能比较非金属性,可利用非金属元素单质的置换反应比较非金属性Cl>S,故A错误;
B.NaCl为中性,NaClO溶液水解显碱性,硫酸氢钠电离显酸性,则含有Z元素的钠盐溶液不一定为中性,故B错误;
C.非金属性越强,对应最高价氧化物对应的水化物的酸性为Z>Y,但氧化性无此规律,故C错误;
D.非金属性R>X,对应氢化物的稳定性为R>X,故D正确;
故选D.
点评 本题考查位置、结构与性质,为高频考点,把握R、Y推断元素为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,选项A为易错点,题目难度不大.


 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有Al3+、Mg2+、Cl- | B. | 肯定有Al3+、Mg2+、NH4+、Cl- | ||
| C. | 肯定有HCO3-、K+、MnO4- | D. | 肯定有Al3+、Mg2+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
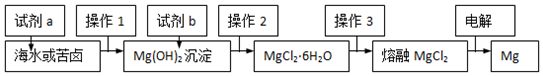
| A. | 流程中试剂a为NaOH溶液,试剂b为盐酸 | |
| B. | 操作2的具体方法是加热浓缩,冷却结晶 | |
| C. | 操作3是将晶体置于HCl气体氛围中脱水 | |
| D. | 电解MgCl2时,阳极生成Cl2,阴极生成Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气可做自来水消毒剂 | B. | 碳酸钠可用于制造玻璃制造肥皂 | ||
| C. | 二氧化硅可用于制造集成电路 | D. | Na2O2用作潜水艇供氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色食品是不含任何化学物质的食品 | |
| B. | 灼烧某物质时,用肉眼直接观察到火焰呈黄色,则可判断该物质一定含钠元素 | |
| C. | 将镁条放在空气中充分燃烧,可以得到三种固体 | |
| D. | 称取等质量的两份铝粉,分别加入过量的稀HCl和过量的NaOH溶液,则放出氢气的体积相等(同温同压下) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
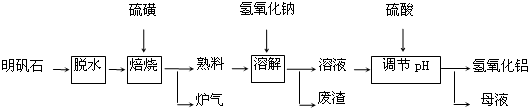
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4mol | B. | 小于0.2mol | ||
| C. | 大于0.2mol | D. | 大于0.2mol,小于0.4mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com