
| A. | 某固体中加入稀盐酸,产生了无色气体,证明该固体一定是CaCO3 | |
| B. | 某溶液中滴加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定含SO42- | |
| C. | 验证烧碱溶液中是否含有Cl-,先加稀盐酸除去OH-,再加硝酸银溶液,有白色沉淀出现,证明含Cl- | |
| D. | 某无色溶液滴入无色酚酞试液显红色,该溶液一定显碱性 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
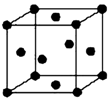 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数与未成对电子数的比值为3:2.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数与未成对电子数的比值为3:2.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S和浓H2SO4 | B. | SO2和NaHCO3溶液 | C. | Cl2和NaHCO3溶液 | D. | Cl2和氯水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 分类组合 | 碱 | 酸 | 盐 | 氧化物 |
| A | Na2CO3 | H2SO4 | NaCl | CO2 |
| B | NaOH | HCl | NaHCO3 | H2SiO3 |
| C | NaOH | H2CO3 | CaCl2 | SO2 |
| D | KOH | NaHSO4 | CaCO3 | CO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13:8 | B. | 8:13 | C. | 16:9 | D. | 9:16 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaNO2是氧化剂 | B. | NaNO2在反应中失电子 | ||
| C. | NH4Cl中的N元素被还原 | D. | N2既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正、逆反应速率都加大,平衡向正反应方向移动 | |
| B. | 正、逆反应速率都没有变化,平衡不发生移动 | |
| C. | 正反应速率加大,逆反应速率减小,平衡向正反应方向移动 | |
| D. | 正反应速率减小,逆反应速率加大,平衡向逆反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com