
【题目】石油炼制过程中产生的大量H2S废气的处理设计方案如下图所示,下列说法不合理的是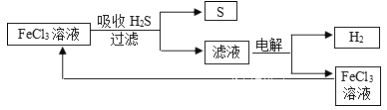
A. 吸收H2S的离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+
B. 电解过程中的阳极可发生的竞争反应主要为:2Cl--2e-=Cl2↑
C. 该工艺流程设计上处理废气H2S的同时也获得产品H2和S
D. 实验室可用点燃充分燃烧的方法消除H2S污染
【答案】D
【解析】A、由图中的流程图可知,FeCl3与H2S反应生成S和Fe2+,离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+,故A正确;B、电解的是氯化亚铁和盐酸溶液,阳极发生氧化反应,所得滤液中含有Fe2+、H+和Cl-,由于还原性Fe2+>Cl-(或根据图示循环),电解时阳极反应式为Fe2+-e-═Fe3+,可以发生的竞争反应为:2Cl--2e-=Cl2↑,故B正确;C、根据流程图,该过程中吸收的H2S最后转化为H2和S,故C正确;D、H2S充分燃烧的化学方程式为2H2S+3O2═2SO2+2H2O,生成的SO2也是一种有毒气体,生成了新的污染物,故D错误;故选D。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律.
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;
乙同学设计了如图2装置来验证卤族元素性质的递变规律.图2中,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气和MnCl2等.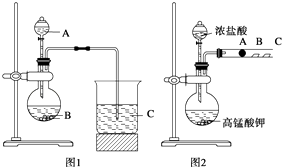
(1)甲同学实验中选用的物质化学式为:A , B , C;
(2)C处反应的离子方程式为;
(3)写出乙同学的实验中圆底烧瓶中发生反应的化学方程式;
(4)A处反应的离子方程式为;
(5)B处的实验现象为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用MnO2与浓盐酸反应来制备氯气:MnO2+4HCl=MnCl2+2H2O+Cl2↑,在此反应中:
(1)氧化产物是;
(2)氧化剂与还原剂的物质的量之比为;
(3)用双线桥法标出电子转移的方向和数目:;
(4)若要产生112mL氯气,则转移的电子数目是;
(5)将此反应改写成离子方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水和苯不互相溶,苯不与钠反应,在烧杯中加水和苯,将一小块钠投入烧杯中,观察到的现象可能是
A. 钠在水层中反应并四处游动 B. 钠停留在苯层中不发生反应
C. 钠在苯的液面上反应并四处游动 D. 钠在苯与水的界面处反应,可能做上下跳动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.在化学反应中,化学能只可以转化为热能
B.合成氨工业中使用铁作催化剂以改变该反应的限度
C.SO2和O2合成SO3的反应中,升高温度,该反应速率减小
D.化学键的断裂和形成是化学反应中能量变化的主要原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中严禁打闹,某几个同学在做实验中打闹而同时把盛有浓盐酸和盛固体KClO3的试剂瓶打破,使其在地上混合立即产生大量黄绿色气体,发生反应的化学方程式为:
KClO3+6HCl(浓) ![]() KCl+3Cl2↑+3H2O
KCl+3Cl2↑+3H2O
(1)该反应中的氧化剂是 .
(2)在化学方程式上标出电子转移的方向和数目 .
(3)如反应中转移了0.50mol电子,则产生的气体在标准状况下体积为L.
(4)在清除碎片时某同学用湿毛巾捂住鼻子防止中毒,有以下四种溶液可浸湿毛巾,它们分别是:①NaOH溶液 ②NaCl溶液 ③KBr溶液 ④NaHCO3溶液.正确选择是(填试剂号数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.25g/mL,质量分数为36.5%的浓盐酸配置240mL 0.1mol/L的盐酸.浓盐酸的物质量浓度为多少?配置稀盐酸应取用的浓盐酸的体积为多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com