
【题目】常见元素A、B、M组成的四种物质发生反应:甲+乙=丙+丁,其中甲由A和M组成,乙由B和M组成,丙中只含有M。
(1)若甲为淡黄色固体,乙和丙均为常温下的无色无味气体。则甲的电子式为___________;常温下丁溶液pH___7(填“>”“<”或“=”),用离子方程式解释原因____________;
(2)若丁为能使品红褪色的无色气体,丁与水反应生成戊,丙为常见红色金属,化合物甲、乙中原子个数比均为1:2(M均显+1价),原子序数B大于A。回答下列问题:
①A在周期表中位置为___________;
②向丁的水溶液中滴入紫色石蕊试液,现象为_____________________;
③写出加热条件下上述生成丙的化学方程式__________________;
④向MCl2的溶液中通入丁,生成白色MCl沉淀,写出该反应的离子方程式__________;
【答案】![]() >CO32-+H2O
>CO32-+H2O![]() HCO3-+OH-第二周期ⅥA族(紫色石蕊变成红色且不褪色2Cu2O+Cu2S=6Cu+SO2↑(条件:加热)2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+
HCO3-+OH-第二周期ⅥA族(紫色石蕊变成红色且不褪色2Cu2O+Cu2S=6Cu+SO2↑(条件:加热)2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+
【解析】
(1)甲+乙=丙+丁,根据甲为淡黄色固体且是两种元素(A和M)组成的化合物,乙和丙均为常温下的无色无味气体,可推知是Na2O2、乙是二氧化碳、丙是氧气、丁是碳酸钠;(2)甲+乙=丙+丁,若丁为能使品红褪色的无色气体,丁是二氧化硫,丁与水反应生成戊,戊是亚硫酸,丙为常见红色金属,丙是铜,化合物甲、乙中原子个数比均为1:2(M均显+1价),原子序数B大于A,则甲是Cu2O、乙是Cu2S。
(1)甲+乙=丙+丁,根据甲为淡黄色固体且是两种元素(A和M)组成的化合物,乙和丙均为常温下的无色无味气体,可推知甲是Na2O2、乙是二氧化碳、丙是氧气、丁是碳酸钠;Na2O2的电子式为![]() ;碳酸钠是强碱弱酸盐,所以碳酸钠能水解,水解离子方程式是CO32-+H2O
;碳酸钠是强碱弱酸盐,所以碳酸钠能水解,水解离子方程式是CO32-+H2O![]() HCO3-+OH-,所以溶液pH>7;(2)甲+乙=丙+丁,若丁为能使品红褪色的无色气体,丁是二氧化硫,丁与水反应生成戊,戊是亚硫酸,丙为常见红色金属,丙是铜,化合物甲、乙中原子个数比均为1:2(M均显+1价),原子序数B大于A,A是氧元素、B是硫元素,则甲是Cu2O、乙是Cu2S。根据以上分析,①O元素在周期表中位置为第二周期ⅥA族;②亚硫酸的水溶液呈酸性,滴入紫色石蕊试液,现象为紫色石蕊变成红色且不褪色;③加热条件下Cu2O、Cu2S生成Cu和SO2的化学方程式是2Cu2O+Cu2S
HCO3-+OH-,所以溶液pH>7;(2)甲+乙=丙+丁,若丁为能使品红褪色的无色气体,丁是二氧化硫,丁与水反应生成戊,戊是亚硫酸,丙为常见红色金属,丙是铜,化合物甲、乙中原子个数比均为1:2(M均显+1价),原子序数B大于A,A是氧元素、B是硫元素,则甲是Cu2O、乙是Cu2S。根据以上分析,①O元素在周期表中位置为第二周期ⅥA族;②亚硫酸的水溶液呈酸性,滴入紫色石蕊试液,现象为紫色石蕊变成红色且不褪色;③加热条件下Cu2O、Cu2S生成Cu和SO2的化学方程式是2Cu2O+Cu2S![]() 6Cu+SO2↑;④向CuCl2的溶液中通入SO2,生成白色CuCl沉淀,该反应的离子方程式是2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+。
6Cu+SO2↑;④向CuCl2的溶液中通入SO2,生成白色CuCl沉淀,该反应的离子方程式是2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+。


科目:高中化学 来源: 题型:
【题目】将一定量的NaHCO3和Na2O2的混合物置于一密闭容器中充分加热,反应中转移的电子数为1mol,下列说法一定正确的是( )
A. 混合物中NaHCO3和Na2O2物质的量一定相等
B. 容器中肯定有0.5molO2
C. 反应后,容器中的固体只有Na2CO3
D. 反应后,容器中一定没有H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】建构数学模型来研究化学问题,既直观又简洁。下列建构的数轴模型正确的是
A. 钠在氧气中燃烧,钠的氧化产物: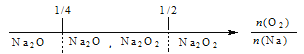
B. 铁在Cl2中燃烧,铁的氧化产物:![]()
C. NH3与Cl2反应,反应产物:
D. FeBr2溶液中通入Cl2,铁元素存在形式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据图中氮元素及其化合物的转化关系,回答问题:
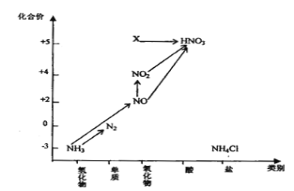
(1)实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为________。
(2)若要收集一瓶氨气,请将下列装置补充完整,在图中虚线框内画出连接图____________。
(3)下列试剂可用于干燥NH3的是____________________。
A.浓硫酸 B.碱石灰 C.CuSO4固体 D.P2O5
(4)工业上以NH3、空气、水为原料生产硝酸:
①NH3→NO化学方程式为________________________________;
②NO→NO2实验现象是________________________________;
③将32.64g铜与一定浓度的HNO3反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。则其中NO、NO2的物质的量比为_____________。
(5)图中X转化为HNO3的化学方程式为:_______________________________。
(6)若要实现NH3→N2,从原理上看,下列试剂可行的是_______________。
A.O2 B.Na C.NH4Cl D. NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“分子筛”是一种具有多孔结构的铝硅酸盐(NaAlSiO4·nH2O),其中有许多笼状孔穴和通道,能让直径比孔穴小的分子通过而将大的分子留在外面,故此得名。利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备“分子筛”的一种工艺流程如下:
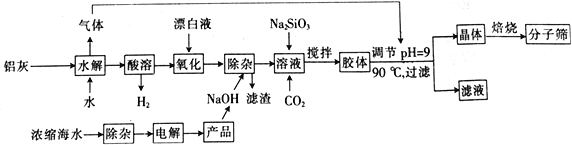
(1)“分子筛”的化学式用氧化物形式可表示为_______________。
(2)铝灰水解产生的气体为________(填化学式);“水解”在加热条件下而不在室温下进行的原因是________________________。
(3)“酸溶”时,发生氧化还原反应的离子方程式为_________________________________。
(4)该工艺中滤渣的颜色为________________________。
(5)某学习小组设计实验模拟从浓缩海水(含Ca2+、Mg2+、SO42-)中提取试剂级NaCl:
![]()
①实验中若向浓缩海水中加入的是Na2CO3浓溶液,则有难溶的Mg2(OH)2CO3生成,同时有气体逸出。该反应的离子方程式为__________________________________。
②该学习小组发现上述实验即使BaCl2用量不足,第Ⅲ步沉淀中依然含有少量BaCO3。从平衡角度分析其原因:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了使Na2S溶液中c(Na+)/c(S2-)的比值变小,可采取的措施是( )
①适量盐酸 ②适量NaOH(s) ③适量KOH(s) ④适量KHS(s) ⑤加水 ⑥适量Cl2溶液⑦加热
A. ②③④ B. ①②⑤⑥⑦
C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,烧杯甲中盛有少量液态冰醋酸,烧杯乙中盛有NH4Cl晶体,在烧杯乙中再加入适量氢氧化钡晶体[Ba(OH)2·8H2O],搅拌,可观察到冰醋酸逐渐凝结为固体。下列有关判断正确的是( )

A. NH4Cl与Ba(OH)2·8H2O反应的焓变(ΔH)小于0
B. 反应物的总能量高于生成物的总能量
C. 反应中有热能转化为产物内部的能量
D. 反应中断裂的化学键只有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用废铅蓄电池的铅泥(含PbSO4、PbO和Pb等)可制备精细化工产品3PbO·PbSO4·H2O(三盐),主要制备流程如下。
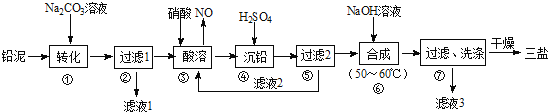
请回答下列问题:
(1)铅蓄电池在生活中有广泛应用,其工作原理是Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O。若铅蓄电池放电前正、负极质量相等,放电时转移了1 mol电子,则理论上两极质量之差为__________。
2PbSO4+2H2O。若铅蓄电池放电前正、负极质量相等,放电时转移了1 mol电子,则理论上两极质量之差为__________。
(2)将滤液1、滤液3合并,经蒸发浓缩、降温结晶、过滤等操作,可得到一种结晶水合物(Mr=322),其化学式为______________________。
(3)步骤③酸溶时铅与硝酸反应生成Pb(NO3)2及NO。滤液2中溶质的主要成分为______(填化学式)。
(4)步骤⑥合成三盐的化学方程式为______________________。
(5)步骤⑦的洗涤操作中,检验沉淀是否洗涤完全的操作方法是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com