

分析 (1)二氧化碳溶于水生成碳酸,碳酸为弱酸,部分电离生成碳酸氢根;
(2)①由图可知:此过程碳酸氢根转化生成碳酸钙,据此书写方程式;
②光合作用是二氧化碳与水在太阳光作用下,在叶绿体中反应生成有机物、放出氧气的过程,氧气来源于水中的氧,据此解答;
(3)①由题意可知,需从酸化后的海水中吹出二氧化碳,那么需要滴加稀酸酸化,且装置中应从长管吹入氮气,从短管吹出二氧化碳,据此解答即可;
②依据原理NaHCO3+HCl=NaCl+CO2↑+H2O解答即可;
(4)a室接电源的正极,为阳极,水失去电子生成氧气和氢离子,氢离子通过阳离子交换膜进入b室,与b室中的碳酸氢根反应生成二氧化碳气体,据此解答即可;
②c室连接电源的负极,为阴极,水得到电子生成氢气和氢氧根,a室中产生氢离子,用c室排除的碱液将从b室排出的酸性海水调节即可,据此解答.
解答 解:(1)二氧化碳溶于水生成的碳酸为弱酸,部分电离生成碳酸氢根,有关方程式为:CO2+H2O?H2CO3,H2CO3?H++HCO3-,或CO2+H2O?HCO3-+H+,
故答案为:CO2+H2O?H2CO3,H2CO3?H++HCO3-或CO2+H2O?HCO3-+H+;
(2)①反应物中含有碳酸氢根,生成物为碳酸钙,依据元素守恒以及电荷守恒得出方程式为:2HCO3-+Ca2+=CaCO3↓+CO2↑+H2O,
故答案为:2HCO3-+Ca2+=CaCO3↓+CO2↑+H2O;
②光合作用产生的氧气来源于水,即水中的氧原子采用示踪法标记为18O,依据元素守恒配平应需要CO2和H218O,故答案为:CO2;H218O;
(3)①酸化海水,可以使用试剂:稀硫酸,利用分液漏斗滴加,长管进气,短管出气,故装置为: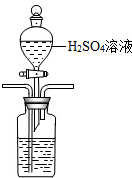 ,
,
故答案为: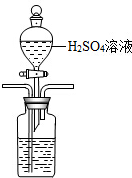 ;
;
②此反应原理为:NaHCO3+HCl=NaCl+CO2↑+H2O,即碳酸氢钠与盐酸的物质的量之比为1:1,那么海水中碳酸氢钠的浓度为c,体积均为mL,依据题意有c×z=xy,解c=$\frac{x•y}{z}$mol/L,故答案为:$\frac{x•y}{z}$;
(4)a室:2H2O-4e-=4H++O2↑,氢离子通过阳离子交换膜进入b室,发生反应:H++HCO3-=CO2↑+H2O,
故答案为:a室:2H2O-4e=4H++O2↑,氢离子通过阳离子交换膜进入b室,发生反应:H++HCO3-=CO2↑+H2O;
②c室:2H2O+2e-=2OH-+H2↑,用c室排出的碱液将从b室排出的酸性海水调节至装置入口海水的pH,
故答案为:c室:2H2O+2e-=2OH-+H2↑,用c室排出的碱液将从b室排出的酸性海水调节至装置入口海水的pH;
点评 本题主要考查的是海水的综合利用以及原电池和电解池的工作原理,充分理解所给信息是解决本题的关键,难度较大.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:选择题
| A. | 生成 SO3 为2mol | |
| B. | 单位时间消耗amol O2,同时消耗2amol SO2 | |
| C. | SO2 和 SO3物质的量之和一定为 2mol | |
| D. | SO2和SO3的浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  | B. | HC≡C-CH2-CH3 | C. | CH2=C(CH3)2 | D. | CH2=CHCH=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4O | B. | CH3CH2OH | C. |  | D. | 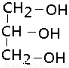 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾净水过程中不涉及化学变化 | |
| B. | 由同种元素组成的物质一定是纯净物 | |
| C. | 风化、石油分馏和碘的升华都是物理变化 | |
| D. | 为除去蛋白质溶液中少量的NaCl,可以利用渗析的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g | B. | 56g | C. | 14g | D. | 无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com