
【题目】某课外活动小组欲利用CuO与NH3的反应研究NH3的性质与分子组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
(1)仪器a的名称为 ;仪器b中的试剂不能为下列中的 (填字母)
A.氧化钙 B.碱石灰 C.石灰石 D.生石灰

(2)装置B的作用是
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管收集到无色无味的气体,上述现象证明了NH3具有 性,写出装置C中发生反应的化学方程式
(4)E装置中浓硫酸的作用 (写出一条即可)
(5)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为 (用含m、n字母的代数式表示)
【答案】(1)分液漏斗,C;(2)干燥氨气;
(3)还原,3CuO+2NH3![]() 3Cu+N2↑+3H2O;
3Cu+N2↑+3H2O;
(4)阻止F中水蒸气进入D(或吸收未反应的氨气);(5)9n/11.2m。
【解析】
试题分析:(1)仪器a的名称为分液漏斗,装置A作用制取NH3,利用NH3·H2O不稳定,受热易分解,氧化钙、碱石灰、生石灰遇水放出大量的热,使NH3·H2O分解,因此选项C正确;(2)装置B的作用是干燥NH3,防止水蒸气对后面实验产生干扰;(3)CuO变为红色铜,铜的化合价降低,且量气管中收集到无色无味的气体,此气体为N2,因此NH3表现还原性,反应方程式为:3CuO + 2NH3![]() 3Cu + N2↑ + 3H2O;(4)装置D的作用是吸收反应中产生的水,同时部分NH3未参加反应,必须吸收,因此装置E的作用是吸收未反应的氨气和防止F中的水蒸气进入D装置;(5)装置D增重的是水的质量,则m(H)=m×2/18g,F中测量的氮气的体积,即n(N)=n×2/22.4mol,则N和H的原子个数比为:n×2/22.4:m×2/18=9n/11.2m。
3Cu + N2↑ + 3H2O;(4)装置D的作用是吸收反应中产生的水,同时部分NH3未参加反应,必须吸收,因此装置E的作用是吸收未反应的氨气和防止F中的水蒸气进入D装置;(5)装置D增重的是水的质量,则m(H)=m×2/18g,F中测量的氮气的体积,即n(N)=n×2/22.4mol,则N和H的原子个数比为:n×2/22.4:m×2/18=9n/11.2m。


科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是
A.一定条件下,0.2 mol SO2与足量O2充分反应,生成SO3分子数为0.2NA
B.0. 1 mol NH2— 中含有的电子数为0.9NA
C.3.4 g H2O2中含有的共用电子对数为0.1NA
D.常温常压下,16 g O2和O3混合气体含有的氧原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含淀粉、NaCl、Na2SO4、CaCl2的混合溶液,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如下:
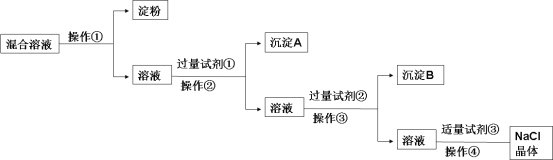
(1)操作①是利用胶体不能通过 而把淀粉胶体和溶液进行分离。
(2)写出上述实验过程中所用试剂的化学式:
试剂①___________________;试剂③_____________________。
(3)判断试剂①已过量的操作是:__________________。
(4)控制试剂③适量的方法是:__________________。
(5)试剂②的作用(用化学方程式表示):__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙醇的说法中,不正确的是
A.乙醇是无色透明、有特殊香味的液体 B.乙醇可以使酸性高锰酸钾溶液褪色
C.乙醇属于烃类物质 D.无水硫酸铜常用于检验乙醇中是否含有水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学变化属于加成反应的是
A.乙醇在铜作催化剂的条件下加热和空气的反应
B.乙烯通入溴的四氯化碳溶液中的反应
C.甲烷在光照条件下与氯气发生的反应
D.苯与液溴在铁粉作催化剂的条件下发生的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
①铝和铜具有良好的导电性,所以电工操作时,可以把铜线和铝线拧在一起
②汽车尾气中含有能污染空气的氮氧化物,主要是汽油燃烧不充分造成的
③从海水中提取物质都必须通过化学反应才能实现
④“辽宁舰”上用于舰载机降落拦阻索的特种钢缆属于新型无机非金属材料
⑤明矾可以用于净水,主要是由于Al3+水解生成的少量氢氧化铝胶体有净水作用
A.②③⑤ B.①②④ C.①③④⑤ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验及显色结果的叙述,错误的是
A.水浴加热条件下,麦芽糖与斐林试剂发生反应生成砖红色沉淀
B.蛋白质溶液遇双缩脲试剂变紫色
C.人的口腔上皮细胞经健那绿染色后,可以看到呈蓝绿色的线粒体
D.常温条件下,脱氧核糖核酸与吡罗红作用呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验。请回答下列有关问题:
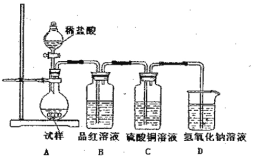
(1)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开能分解,且分解产物只有硫化钠和另种固体。如果加热温度低于字600℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,在滴加稀盐酸的整个过程中HSO3-的物质的量浓度变化趋势为 ;
(2)如果加热温度为700℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则反应生生成黄色沉淀的离子方程式为 ;此时在B、C两装置中可能观察到的现象为 。
(3)在(2)中滴加定暈盐酸后,烧瓶内除Cl-外还存在另一种浓度较大的阴离子(X)。为检验该阴离子(X),先取固体试样溶于水配成溶液,然后按以下两种实验方案检验阴离子(X),认为合理的方案是 (填“甲”或“乙”),请说明另一种方案不合理的原因 。
方案甲:取少量试样溶液于试管中,先加稀HNO3,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
方案乙:取少量试样溶液于液管中,先如稀HCl,再加BaCl2溶液,有白色淀淀生成,证明该离子存在。
(4)写出Na2SO3固体加热到600℃以上分解的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com