
【题目】下列说法正确的是( )
A.在合成氨工业中,移走NH3可增大正反应速率,提高原料转化率
B.恒温下进行的反应2NO2(g)![]() N2O4(g)达平衡时,缩小容器体积再达平衡时,气体的颜色比第一次平衡时的深,NO2的体积分数比原平衡大
N2O4(g)达平衡时,缩小容器体积再达平衡时,气体的颜色比第一次平衡时的深,NO2的体积分数比原平衡大
C.常温下,MgO(s)+C(s)=Mg(s)+CO(g)不能自发进行,则其△H>0
D.对于反应3KSCN(aq)+FeCl3(aq)![]() Fe(SCN)3(aq)+3KCl(aq),加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大
Fe(SCN)3(aq)+3KCl(aq),加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大
科目:高中化学 来源: 题型:
【题目】某![]() 样品中含有
样品中含有![]() 和
和![]() 杂质,现欲制取纯净的
杂质,现欲制取纯净的![]() ,某同学设计如图的实验方案。请回答下列问题:
,某同学设计如图的实验方案。请回答下列问题:

(1)操作Ⅰ的名称是______,在该操作中用到的玻璃仪器除了有烧杯、玻璃棒,还有______
(2)沉淀A的成分是______![]() 填化学式
填化学式![]() ,写出第③步反应中铝元素转化的离子方程式______
,写出第③步反应中铝元素转化的离子方程式______
(3)写出证明滤液B中![]() 已沉淀完全的实验方法______
已沉淀完全的实验方法______
(4)不改变上述流程图的结构,将“①过量盐酸”“②过量NaOH”交换位置,则“③过量![]() ”应改为_____,写出此方案下生成沉淀B的离子方程式______
”应改为_____,写出此方案下生成沉淀B的离子方程式______
(5)为了得到更加纯净的![]() ,过滤后需要进行操作步骤是______
,过滤后需要进行操作步骤是______
(6)写出工业由氧化铝冶炼铝的化学方程式______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,N表示粒子数。下列叙述正确的是( )
A. 在标准状况下2.24LCCl4中含有的C—Cl键数为0.4NA
B. 将1mol Cl2通入水中,则N(HClO)+N(Cl)+N(ClO)=2NA
C. 将CO2通过Na2O2使其质量增加a g时,反应转移的电子数为aNA/14
D. 3.0g含甲醛(HCHO)的冰醋酸中含有的原子总数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的氯气通入50mL 10.00 mol·L-1的氢氧化钠浓溶液中,加热少许时间后,溶液中只有NaCl、NaClO、NaClO3三种溶质。下列说法正确的是
A.与NaOH反应的氯气物质的量:0.25mol<n(Cl2)<0.5mol
B.若反应中转移的电子为n mol,则0.25<n<0.5
C.溶液中n(Na+):n(Cl-)可能为7:5
D.溶液中n(NaCl):n(NaClO):n(NaClO3)可能为10:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A2 + 3B2(?)![]() 2AB3(g)中,AB3的百分含量(w)与温度和压强的关系如图所示。下列说法正确的是( )
2AB3(g)中,AB3的百分含量(w)与温度和压强的关系如图所示。下列说法正确的是( )
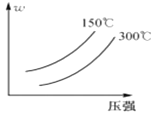
A.该反应为吸热反应
B.反应物B2为气体
C.升高温度,逆反应速率减慢
D.增大压强,A2转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在一定条件下2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-QkJ·mol-1。向一密闭容器中加入2molSO2和1molO2,达平衡时SO2的转化率为90%,放出的热量为Q1;向另一相同容器中加入2molSO3,在相同条件下,达平衡时吸收的热量为Q2,则下列关系中正确的是( )
2SO3(g) ΔH=-QkJ·mol-1。向一密闭容器中加入2molSO2和1molO2,达平衡时SO2的转化率为90%,放出的热量为Q1;向另一相同容器中加入2molSO3,在相同条件下,达平衡时吸收的热量为Q2,则下列关系中正确的是( )
A. Q>Q1>Q2B. Q2>Q>Q1C. Q1>Q>Q2D. Q>Q1=Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,X是一种生活中常见的金属元素,A、B、C、D为石墨电极,E、F分别为短周期相邻两种活泼金属中的一种,且E能与NaOH溶液反应。按图示接通线路,反应一段时间(实验中所有溶液均足量)。

(1)甲池是___(填“原电池”或“电解池”,下同)装置;乙池是___装置。
(2)D极为___(填“阴极”或“阳极”)。
(3)烧杯中溶液会变蓝的是____(填“a”或“b”);C极上的电极反应式为___________________________。
(4)F极上的电极反应式为:_________________________________________________。
(5)当电路中通过0.02mol电子时,B电极上沉积0.64g金属X,则X为___(填元素符号),甲池中反应的化学方程式为______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图![]() 甲不一定在丁、庚的连线上
甲不一定在丁、庚的连线上![]() ,戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是
,戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是

A.甲与己形成的化合物一定是离子化合物
B.简单气态氢化物的稳定性:庚![]() 己
己![]() 戊
戊
C.乙、丙、丁的最高价氧化物水化物可以相互反应
D.庚的最高价氧化物水化物酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性小组决定用实验探究的方法证明化学反应具有一定的限度。取5mL 0.1mol/L KI溶液于试管中,滴加0.1mol/L FeCl3溶液2mL,发生如下反应:2Fe3++2I-![]() 2Fe2++I2。为证明该反应具有可逆性且具有限度,他们设计了如下实验:
2Fe2++I2。为证明该反应具有可逆性且具有限度,他们设计了如下实验:
①取少量反应液,滴加AgNO3溶液,发现有少量黄色沉淀(AgI),证明反应物没有反应完全;
②再取少量反应液,加入少量CCl4,振荡,发现CCl4层显浅紫色,证明萃取到I2,即有I2生成。综合①②的结论,他们得出该反应具有一定的可逆性,在一定条件下会达到反应限度。
(1)老师指出他们上述实验中①不合理,你认为是_____________________________;在不改变反应物用量的前提下,改进的方法是_____________________________________________。
(2)有人认为步骤②适合检验生成I2较多的情况下,还有一种简便方法可以灵敏地检验是否生成了I2,这种方法是______________________________。
(3)控制适合的条件,将反应2Fe3++2I-![]() 2Fe2++I2,设计成如图所示的原电池。
2Fe2++I2,设计成如图所示的原电池。

①反应开始时,乙中石墨电极上发生____________(填“氧化”或“还原”)反应,电极反应式为_________________________。
②电流计读数为0时,反应达到平衡状态。此时在甲中加入FeCl2固体,发现电流计又发生偏转,则甲中的石墨作_______(填“正”或“负”)极,该电极的电极反应式为_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com