
| A、酒精和水 | B、碘和汽油 |
| C、水和四氯化碳 | D、食盐和水 |
科目:高中化学 来源: 题型:
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
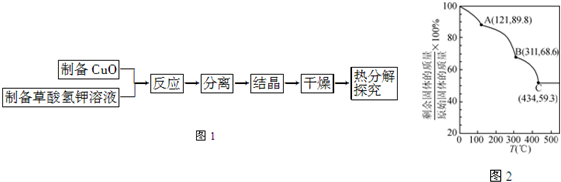
| ||
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 银盐 性质 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.34×10-6 | 7.1×10-7 | 1.1×10-8 | 6.5×10-5 | 1.0×10-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、聚乙烯食品包装袋、食物保鲜膜都是无毒的高分子化合物 |
| B、煤经过气化和液化两个物理变化,可变为清洁能 |
| C、高温能杀死流感病毒是因为构成病毒的蛋白质受热变性 |
| D、太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度下,在2L密闭容器中X、Y、Z三种物质(均为气态)间进行反应,其物质的量随时间的变化曲线如图.依图回答:
某温度下,在2L密闭容器中X、Y、Z三种物质(均为气态)间进行反应,其物质的量随时间的变化曲线如图.依图回答:查看答案和解析>>
科目:高中化学 来源: 题型:
 今有某一种碱金属的两种碳酸盐和碱土金属(第ⅡA族)的一种不溶性碳酸盐组成的混合物,取其7.560g与过量盐酸完全反应,放出CO2体积为1.344L(标况下),另取等质量的原混合物,加水搅拌,可滤出不溶性盐1.420g.
今有某一种碱金属的两种碳酸盐和碱土金属(第ⅡA族)的一种不溶性碳酸盐组成的混合物,取其7.560g与过量盐酸完全反应,放出CO2体积为1.344L(标况下),另取等质量的原混合物,加水搅拌,可滤出不溶性盐1.420g.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com