
【题目】R、W、X、Y、M是原子序数依次增大的五种主族元素。R最常见同位素的原子核中不含中子。W与X可形成两种稳定的化合物:WX和WX2。工业革命以来,人类使用的化石燃料在燃烧过程中将大量WX2排入大气,在一定程度导致地球表面平均温度升高。Y与X是同一主族的元素,且在元素周期表中与X相邻。
(1)W的原子结构示意图是__________________________。
(2)WX2的电子式是_______________________。
(3)R2X、R2Y中,稳定性较高的是____(填化学式),请从原子结构的角度解释其原因:_____。
(4)Se与Y是同一主族的元素,且在元素周期表中与Y相邻。
①根据元素周期律,下列推断正确的是________(填字母序号)。
a.Se的最高正化合价为+7价
b.H2Se的还原性比H2Y强
c.H2SeO3的酸性比H2YO4强
d.SeO2在一定条件下可与NaOH溶液反应
②室温下向SeO2固体表面吹入NH3,可得到两种单质和H2O,该反应的化学方程式为_____________。
(5)科研人员从矿石中分离出一种氧化物,化学式可表示为M2O3。为确定M元素的种类,进行了一系列实验,结果如下:
①M的相对原子质量介于K和Rb(铷)之间;
②0.01 mol M2O3在碱性溶液中与Zn充分反应可得到M的简单氢化物,反应完全时,被M2O3氧化的Zn为0.06 mol;
综合以上信息推断,M可能位于元素周期表第_________________族。
【答案】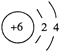
![]() H2O 氧原子与硫原子最外层电子数相同,电子层数S>O,原子半径S>O,得电子能力S<O,元素的非金属性S<O,因此,H2S的稳定性弱于H2O bd 3SeO2+4NH3=3Se + 2N2 + 6H2O VA
H2O 氧原子与硫原子最外层电子数相同,电子层数S>O,原子半径S>O,得电子能力S<O,元素的非金属性S<O,因此,H2S的稳定性弱于H2O bd 3SeO2+4NH3=3Se + 2N2 + 6H2O VA
【解析】
R最常见同位素的原子核中不含中子,则R为H元素;W与X可形成两种稳定的化合物:WX和WX2。工业革命以来,人类使用的化石燃料在燃烧过程中将大量WX2排入大气,在一定程度导致地球表面平均温度升高,则WX2为CO2,W为C元素,X为O元素;Y与X是同一主族的元素,且在元素周期表中与X相邻,则Y为S元素。
(1)W为C元素,原子结构示意图为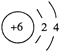 ,
,
答案为: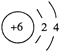 ;
;
(2)WX2为CO2,电子式是![]() ,
,
答案为:![]() ;
;
(3)R为H元素,X为O元素,Y为S元素,R2X、R2Y分别为H2O、H2S,氧原子与硫原子最外层电子数相同,电子层数S>O,原子半径S>O,得电子能力S<O,元素的非金属性S<O,因此,H2S的稳定性弱于H2O,
答案为:H2O;氧原子与硫原子最外层电子数相同,电子层数S>O,原子半径S>O,得电子能力S<O,元素的非金属性S<O,因此,H2S的稳定性弱于H2O;
(4)Se与S是同一主族的元素同主族元素从上到下,随着核电荷数增大,非金属性减弱,半径逐渐增大。
a.Se与S是同一主族的元素,最外层电子数为6,Se的最高正化合价为+6价,故a错误;
b.单质的氧化性越强,其离子的还原性越弱,S的氧化性强于Se,则S2-还原性弱于Se2-,因此H2Se的还原性比H2S强,故b正确;
c.非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性S>Se,则H2SeO3的酸性比H2SO4弱,故c错误;
d.同主族元素化学性质具有相似性,SO2属于酸性氧化物可与NaOH溶液反应,则SeO2在一定条件下也可与NaOH溶液反应,故d正确;
答案选bd;
②室温下向SeO2固体表面吹入NH3,可得到两种单质和H2O,根据物料守恒,生成的单质应为N2和Se,利用氧化还原反应得失电子守恒,该反应的化学方程式为3SeO2+4NH3=3Se + 2N2 + 6H2O,
答案为:3SeO2+4NH3=3Se + 2N2 + 6H2O;
(5)0.01 mol M2O3在碱性溶液中与Zn充分反应可得到M的简单氢化物,则氢化物中M的化合价为最低价态,M为主族元素,M最高正价=8-M最低负价的绝对值,设M的氢化物中化合价为-x价,则M由+3价变为-x价,0.01 mol M2O3完全反应共得到2×(3+x)×0.01 mol的电子,金属Zn由0价变为+2价,被M2O3氧化的Zn为0.06 mol,共失去2×0.06 mol的电子,根据得失电子守恒,2×(3+x)×0.01=2×0.06,解得x=3,则M的氢化物中化合价为-3价,则M最高正价=8-3=+5,主族元素最高正价等于最外层电子数,最外层电子数等于主族序数,故M可能位于元素周期表第VA族,
答案为:VA;


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】厌氧氨化法是一种新型的氨氮去除技术,下列说法中正确的是( )
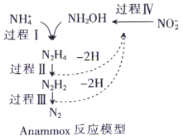
A.1molNH4+中所含的质子总数为10NA
B.1mol联氨(N2H4)中含有5mol共用电子对
C.NH2OH中既含有极性键也含有非极性键
D.该方法每处理1molNH4+,需要的NO2-为0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
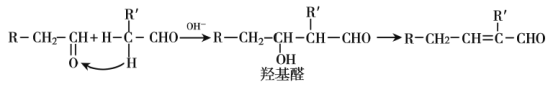
【题目】已知:醛分子在稀碱溶液存在下,可发生羟醛缩合反应,生成羟基醛,如:
某有机物的合成路线如下:
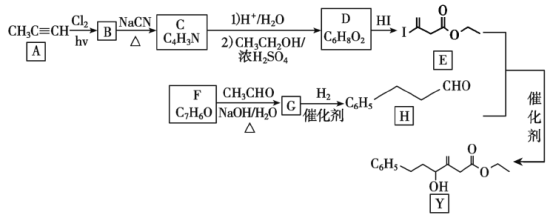
回答下列问题:
(1)A中官能团名称是___,F的名称是___。
(2)由A生成B、G生成H的反应类型分别是___、___。
(3)B为单氯代烃,由B生成C的化学方程式为___。
(4)D的结构简式为___。
(5)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出2种符合上述条件的X的结构简式___。
(6)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。用星号(*)标出Y中的手性碳___。
(7)苯乙酸苄酯(![]() )是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线___(无机试剂任选)。
)是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线___(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中从反应开始至平衡以CO2表示的平均反应速率为v(CO2)=____(取小数点后两位,下同)。
②该反应的正反应为___(填“吸”或“放”)热反应,实验2条件下平衡常数K=___。
(2)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,达到平衡后下列措施中能使c(CH3OH)增大的是____。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,达到平衡后下列措施中能使c(CH3OH)增大的是____。
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1 mol CO2和3 mol H2

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三只烧杯中,依次分别盛有NaOH溶液、KSCN溶液、煮沸的蒸馏水,各滴入FeCl3溶液,试根据实验现象分别回答以下问题:
(1)分别写出三只烧杯中形成分散系的名称:
A________,B________,C________。
(2)写出C中形成分散系的化学方程式:_____________________________________。
(3)若不用化学试剂鉴别,写出鉴别B、C分散系的两种简单方法:
①______________________________________________________,
②________________________________________________________。
(4)向C中逐滴加入稀H2SO4,现象为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京市场销售的某种食用精制盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配 料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
分装时期 | |
分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
____KIO3+___KI+___H2SO4=___K2SO4+___I2+___H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是_________________________________。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是______________________。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是______________________。
②b中反应所产生的I2的物质的量是___________mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
_______________________mg/kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示装置(图中夹持仪器略去)测定牙膏样品中碳酸钙的质量分数,下列说法错误的是
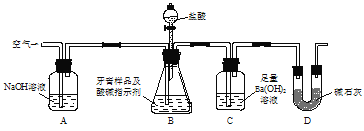
A.实验过程中持续通入空气可起到搅拌B、C中的反应物的作用
B.实验过程中滴加盐酸的速率不宜过快
C.依据装置C在反应前后的质量差测定的结果会偏高
D.C中的沉淀经过滤、干燥、称重后可确定牙膏样品中碳酸钙的质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯化铁水解的离子方程式为_________________________________,实验室配制氯化铁溶液时,常将氯化铁先溶于浓盐酸,然后再加水稀释,其目的是_________________________。
(2)若向氯化铁溶液中加入碳酸钙粉末,碳酸钙逐渐逐渐溶解,并产生无色气体的离子方程式为________,溶液中同时有红褐色沉淀生成,其原因是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com