
| A. | NaCl | B. | H2 | C. | H2O | D. | NaOH |
科目:高中化学 来源: 题型:选择题
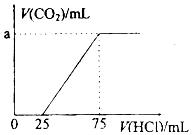 取一定量的NaOH溶液通入CO2后,再继续向该溶液中逐滴加入0.1mol/L的盐酸,产生CO2的体积与所加盐酸体积之间的关系如图所示,下列说法正确的是( )
取一定量的NaOH溶液通入CO2后,再继续向该溶液中逐滴加入0.1mol/L的盐酸,产生CO2的体积与所加盐酸体积之间的关系如图所示,下列说法正确的是( )| A. | 原溶液中NaOH的物质的量为0.75mol | |
| B. | 通入CO2后所得的溶液溶质成分为NaOH和Na2CO3 | |
| C. | 通入CO2后所得的溶液中含有2.5mol NaHCO3 | |
| D. | 原溶液通入CO2标准状况下为112mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
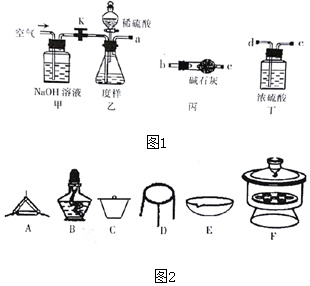
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铝可作胃酸的中和剂 | |
| B. | 绚丽缤纷的烟花中添加了含钾、钙、钠、铜等金属元素的化合物 | |
| C. | SiO2、NaOH、HF三者两两均能反应 | |
| D. | 制备单晶硅的过程中不发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加少量稀NaOH溶液 | B. | 加入少量NaNO3固体 | ||
| C. | 加入少量NaHSO4固体 | D. | 加入少量CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X:位于元素周期表中的第三周期ⅢA 族 | |
| B. | 元素Y:它的二价阳离子核外电子总数与氖原子相同 | |
| C. | 元素Z:它的原子中M层比L层少2个电子 | |
| D. | 元素W:它的化合物的焰色反应颜色呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
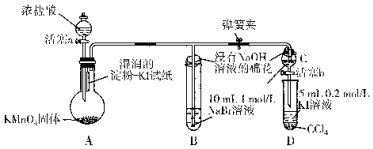
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com