
【题目】苯酚与苯甲醇共同具有的性质是( )
A. 能与NaOH溶液反应
B. 能与钠反应放出H2
C. 呈现弱酸性
D. 都能发生消去反应
 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】锂锰电池的体积小,性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,生成LiMnO2。
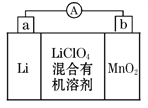
回答下列问题:
(1)外电路的电流方向是由__________极流向__________极。(填字母)
(2)电池正极反应式为________________________________________。
(3)是否可用水代替电池中的混合有机溶剂?_______(填“是”或“否”);原因是____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中的实线表示元素周期表的部分边界,a-1分别表示周期表中对应位置的元素。

(1)请在上表中用实线补全元素周期表边界____。
(2)表中所列元素,不属于短周期元素有____,不属于主族元素的有___(填相应的元素符号)
(3)指出下列元素在周期表中的位置:
①b元素位于第___周期___族;
②g元素位于第___周期___族;
③i元素位于第___周期___族;
(4)①写出b与c的化合物(温室气体)电子式:___________;
②用电子式表示k与h化合物形成过程:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芦笋中的天冬酰胺(结构如右图)和微量元素硒、铬锰等,具有提高身体免疫力的功效。
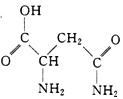
(1)天冬酰胺所含元素中, (填元素名称)元素基态原子核外未成对电子数最多。
(2)天冬酰胺中碳原子的杂化轨道类型有 种。
(3)H2S和H2Se的参数对比见下表。
化学式 | 键长/nm | 键角 | 沸点/℃ |
H2S | 1.34 | 92.3 | -60.75 |
H2Se | 1.47 | 91.0 | -41.50 |
①H2Se的晶体类型为 ,含有的共价键类型为 。
②H2S的键角大于H2Se的原因可能为 。
(4)已知铝(Mo)位于第五周期VIB族,钼、铬、锰的部分电离能如下表所示
编号 | I5/KJ·mol-1 | I6/KJ·mol-1 | I7/KJ·mol-1 | I8/KJ·mol-1 |
A | 6990 | 9220 | 11500 | 18770 |
B | 6702 | 8745 | 15455 | 17820 |
C | 5257 | 6641 | 12125 | 13860 |
A是 (填元素符号),B的价电子排布式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列作用不属于水解反应的是
A.吃馒头时多咀嚼后有甜味
B.淀粉溶液和稀硫酸共热一段时间后,滴加碘水不显蓝色
C.不慎将浓硝酸沾到皮肤上会出现黄色斑痕
D.油脂与氢氧化钠溶液共煮后可以制得肥皂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏伽德罗常数的值,下列叙述不正确的是
A.72g SiO2晶体含4.8NA个σ键
B.1mol[Cu(NH3)4]2+中含4NA配位键
C.在2.4g石墨中,含C-C共价键数目为0.3NA
D.CO和N2等电子体,22.4L的CO气体与1molN2所含的电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷为同主族元素,回答下列问题:
(1)基态As原子的核外电子排布式为___________________。
(2)稼氮砷合金材料的太阳能电池效率达40%,Ga、N、As电负性由大至小的顺序是__________________
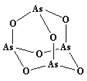
(3)As4O6的分子结构如右图所示,其中As原子的杂化方式为___________________,1 mol As4O6含有σ键的物质的量为_______________。
(4)该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如右图所示。则Y轴可表示的氢化物(RH3)性质可能是 。
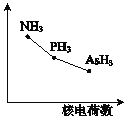
A.稳定性 | B.沸点 | C.R-H键能 | D.分子间作用力 |
(5)AsH3的沸点(-62.5℃)比NH3的沸点(-33.5℃)低,原因是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2015浙江理综化学】Ⅰ.请回答:
(1)H2O2的电子式___________。
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由________________。
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式_____________。
(4)完成以下氧化还原反应的离子方程式:
( )MnO4-+( )C2O42-+______=( )Mn2++( )CO2↑+________
Ⅱ.化合物甲和NaAlH4都是重要的还原剂。一定条件下金属钠和H2反应生成甲。甲与水反应可产生H2,甲与AlCl3反应可得到NaAlH4。将4.80g甲加热至完全分解,得到金属钠和2.24 L(已折算成标准状况)的H2。
请推测并回答:
(1)甲的化学式__________。
(2)甲与AlCl3反应得到NaAlH4的化学方程式__________。
(3)NaAlH4与水发生氧化还原反应的化学方程式__________。
(4)甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学方程式 。
(5)某同学认为:用惰性气体赶尽反应体系中的空气,将铁和盐酸反应后的气体经浓硫酸干燥,再与金属钠反应,得到固体物质即为纯净的甲;取该固体物质与水反应,若能产生H2,即可证明得到的甲一定是纯净的。
判断该同学设想的制备和验纯方法的合理性并说明理由___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计了如下图装置,不断改变A中溶液成份反应以探究SO2气体的性质
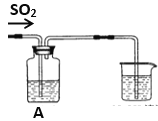
(1)如果A中盛有氢硫酸溶液,通入SO2气体后可观察到有浅黄色浑浊出现,则证明SO2有_________性;写出化学反应方程式____________________________________
(2)如果A中盛有酸性高锰酸钾溶液,通入SO2气体后实验现象是________________,证明SO2有_______性。
(3)如果A中盛有稀硝酸钡溶液, 通入SO2气体后可观察到出现白色沉淀,有无色NO气体生成,写出离子反应方程式_______________________________________________。
(4)如果A中盛有氯化钡溶液,通入SO2气体后本应无沉淀生成,但同学们发现在溶液中也有少量白色沉淀。甲同学把此白色沉淀过滤出来,该沉淀不溶于盐酸。该同学猜测是由于装置中空气没有排净,参与了反应,试写出离子反应方程式_____________________________________。
(5)如果A中盛有纯碱水溶液,写出向A中缓缓加入少量SO2的离子反应方程式____________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com