
| A. | 向NaAlO2溶液中滴入NaHCO3溶液有白色沉淀,原因是二者可以发生双水解反应 | |
| B. | 电解精炼铜时,若阴极得到1.204×1024个电子,则阳极质量减少6.4g | |
| C. | 使甲基橙变红色溶液:Mg2+、K+、SO42-、NO3-能大量共存 | |
| D. | Na2S在空气中长期放置变浑浊的离子方程式为:2S2-+O2+4H+=2S+2H2O |
分析 A.碳酸氢根离子的酸性大于氢氧化铝,二者反应生成氢氧化铝沉淀和碳酸根离子,不是发生双水解反应;
B.粗铜中含有比金属铜活泼的金属铁、锌等,电解时,阳极放电的先是铁和锌,最后是铜;
C.使甲基橙变红色溶液中存在大量氢离子,四种离子之间不反应,都不与氢离子反应,能够共存;
D.硫化钠溶液在空气中能够被氧气氧化成硫单质,反应物中的水不能拆开.
解答 解:A.由于碳酸氢根离子的酸性大于氢氧化铝,则向NaAlO2溶液中滴入NaHCO3溶液生成氢氧化铝沉淀和碳酸钠,没有发生双水解反应,故A错误;
B.粗铜中含有比金属铜活泼的金属铁、锌等,电解时,阳极放电的先是铁和锌,最后是铜,所以当转移的电子数为1.204×1024个时,则阳极溶解的铜的质量小于64g,故B错误;
C.使甲基橙变红色溶液为酸性溶液,溶液中存在大量氢离子,Mg2+、K+、SO42-、NO3-之间不发生反应,都不与氢离子反应,在溶液中能够大量共存,故C正确;
D.Na2S在空气中长期放置变浑浊,是硫离子的还原性被空气中的氧气氧化生成硫单质,反应物中水不能写出氢离子,正确的离子方程式为:2S2-+02+2H20=2S+40H-,故D错误;
故选C.
点评 本题考查较为综合,涉及离子共存、离子方程式书写、电解原理等知识,明确离子反应发生条件为解答关键,注意掌握离子方程式书写原则,A为易错点,注意偏铝酸根离子与碳酸氢根离子的反应不属于双水解反应.


 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCHCl3中含有的氯原子数目为3NA | |
| B. | 46g二氧化氮含有的原子总数一定为3NA | |
| C. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2NHO3+4N2↑+9H2O该反应生成28gN2时,转移的电子数目为4NA | |
| D. | 在密闭容器中加入1,5molH2和0.5molN2,充分反应后可得到NH3分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
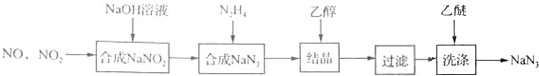
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
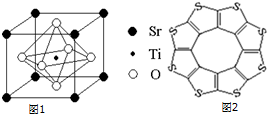
| C-S | C═S | C16S8中碳硫键 | |
| 键长/pm | 181 | 155 | 176 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入盐酸以除去硫酸钠中少量的碳酸钠杂质 | |
| B. | 用玻璃棒搅拌漏斗中的液体以加快反应速率 | |
| C. | 用稀硫酸和锌反应制氢气时加入少许硫酸铜以加快反应速率 | |
| D. | 在容量瓶中加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态HCl不导电,所以HCl不是电解质 | |
| B. | NH3溶于水形成的溶液能导电,所以NH3是电解质 | |
| C. | Cl2溶于水能导电,所以Cl2是电解质 | |
| D. | BaSO4在水溶液中难导电,但熔融下能导电所以BaSO4是电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com