
 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解.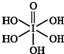 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4(填“>”“<”或“=”).
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4(填“>”“<”或“=”).分析 (1)根据含氧酸中,酸的元数取决于羟基氢的个数,含非羟基氧原子个数越多,酸性越强;
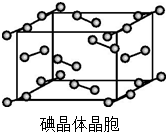
(2)同种非金属元素之间形成非极性共价键,碘为分子晶体,碘晶体中的碘原子间存在非极性键和范德华力,晶胞中占据顶点和面心,碘分子的排列有2种不同的取向.
解答 解:(1)H5IO6(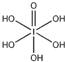 )中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有1个羟基氢,含非羟基氧原子3个,所以酸性:H5IO6<HIO4;
)中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有1个羟基氢,含非羟基氧原子3个,所以酸性:H5IO6<HIO4;
故答案为:<;
(2)A.碘分子的排列有2种不同的取向,在顶点和面心不同,2种取向不同的碘分子以4配位数交替配位形成层结构,故A正确;
B.用均摊法可知平均每个晶胞中有4个碘分子,即有8个碘原子,故B错误
C.碘晶体为无限延伸的空间结构,构成微粒为分子,是分子晶体,故C错误;
D.碘晶体中的碘原子间存在I-I非极性键,且晶体中分子之间存在范德华力,故D正确;
故答案为:AD.
点评 本题主要考查含氧酸酸性比较、晶体结构与性质,侧重物质结构与比较方法的考查,注意把握规律性知识的应用,题目难度中等.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
| A. | 2.4g Mg在足量O2中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,5.6L CO2气体中含有氧原子数为0.5NA | |
| C. | 氢原子数为0.4NA的CH3OH分子中含有的σ键数为0.4NA | |
| D. | 0.1L 0.5mol•L-1 CH3COOH溶液中含有的H+数为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4L O2所含的原子数为2NA | |
| B. | 标准状况下,22.4L H2所含的分子数为NA | |
| C. | 标准状况下,22.4L H2O所含的分子数为NA | |
| D. | 56g铁粉与盐酸完全反应时转移电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
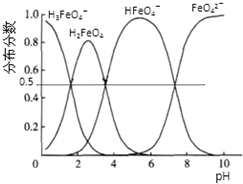
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
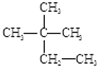 ③O2④18O ⑤
③O2④18O ⑤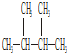
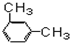 ⑩
⑩
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的相对分子质量为34g | |
| B. | CH4的摩尔质量为16 g | |
| C. | 1 mol SO42--的质量为96g | |
| D. | 标准状况下1 mol H2O 的体积是22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.2mol | B. | 1.6mol | C. | 0.4mol | D. | 0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
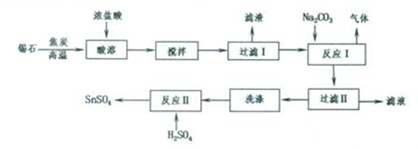
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com