
| A. | 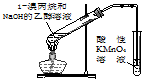 装置用于检验消去产物 | B. | 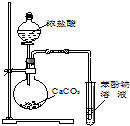 装置检验酸性:盐酸>碳酸>苯酚 | ||
| C. | 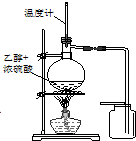 装置用于实验室制取并收集乙烯 | D. | 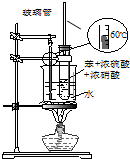 装置用于实验室制硝基苯 |
分析 A.乙醇易挥发,乙醇能被高锰酸钾氧化;
B.盐酸易挥发,盐酸与苯酚钠发生强酸制取弱酸的反应;
C.乙醇发生消去反应制备乙烯,需要控制反应液的温度为170℃;
D.苯与浓硝酸、浓硫酸发生取代反应制备硝基苯,需要控制水浴温度为60℃.
解答 解:A.乙醇易挥发,乙醇、乙烯均能被高锰酸钾氧化,则不能检验产物中有乙烯,故A错误;
B.盐酸易挥发,盐酸与苯酚钠发生强酸制取弱酸的反应,则图中装置不能比较碳酸、苯酚的酸性,故B错误;
C.乙醇发生消去反应制备乙烯,需要控制反应液的温度为170℃,则温度计水银球应在液面下,故C错误;
D.苯与浓硝酸、浓硫酸发生取代反应制备硝基苯,需要控制水浴温度为60℃,则图中装置可制备硝基苯,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质实验、制备实验及实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Ag2O与CuCl反应的化学方程式为Ag2O+2CuCl═2AgCl+Cu2O | |
| B. | Ag2O溶于稀硝酸的离子方程式为Ag2O+2H+═2Ag++H2O | |
| C. | CuCl可以用铜在氯气中燃烧来制备 | |
| D. | 可以用稀硝酸来鉴别Ag2O与CuCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
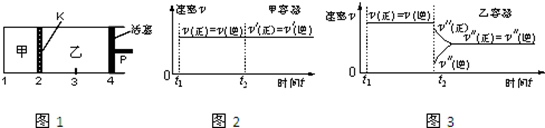
| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中 C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
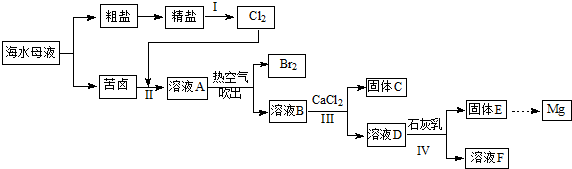
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑥⑦ | C. | ②③⑤⑥⑦ | D. | ①②⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
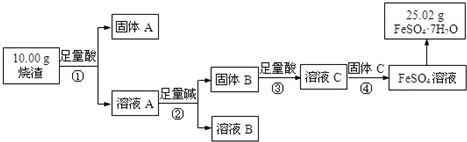
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com