
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
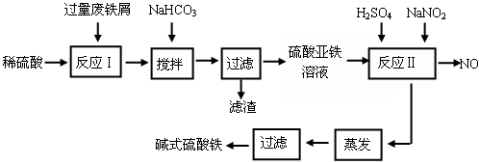
分析 废铁屑中含少量氧化铝、氧化铁等,将过量废铁屑加入稀硫酸中,发生反应 Fe+H2SO4=FeSO4+H2↑、Al2O3+3H2SO4=Al2(SO4)3+3H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Fe2(SO4)3+Fe=3FeSO4,然后反应I中加入NaHCO3并搅拌,调节溶液的pH,发生反应Al3++3HCO3-=Al(OH)3↓+3CO2↑,所以滤渣中成分是Al(OH)3,过滤得到硫酸亚铁,向硫酸亚铁溶液中加入稀硫酸和NaNO2,酸性条件下,NaNO2和FeSO4发生氧化还原反应生成铁离子、NO,将溶液蒸发浓缩、过滤得到碱式硫酸铁.
(1)根据氢氧化物沉淀需要的pH知,在pH在4.4-7.5之间将铝离子转化为Al(OH)3沉淀,而亚铁离子不能生成沉淀,搅拌加快溶解速率;
(2)酸性条件下,亚硝酸钠具有氧化性,能将亚铁离子氧化为铁离子,自身被还原生成NO,所以反应Ⅱ中加入NaNO2的目的是氧化Fe2+;
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+聚合离子;
(4)亚铁离子具有还原性,能被强氧化剂氧化生成铁离子,反应过程中颜色变化明显的效果最佳.
解答 解:废铁屑中含少量氧化铝、氧化铁等,将过量废铁屑加入稀硫酸中,发生反应 Fe+H2SO4=FeSO4+H2↑、Al2O3+3H2SO4=Al2(SO4)3+3H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Fe2(SO4)3+Fe=3FeSO4,然后反应I中加入NaHCO3并搅拌,调节溶液的pH,发生反应Al3++3HCO3-=Al(OH)3↓+3CO2↑,所以滤渣中成分是Al(OH)3,过滤得到硫酸亚铁,向硫酸亚铁溶液中加入稀硫酸和NaNO2,酸性条件下,NaNO2和FeSO4发生氧化还原反应生成铁离子、NO,将溶液蒸发浓缩、过滤得到碱式硫酸铁,
(1)根据氢氧化物沉淀需要的pH知,在pH在4.4-7.5之间将铝离子转化为Al(OH)3沉淀,而亚铁离子不能生成沉淀,所以条件溶液的pH范围为4.4-7.5之间,使溶液中的杂质离子沉淀.该工艺中“搅拌”的作用是增大接触面积、加快反应速率,
故答案为:4.4-7.5;增大接触面积、加快反应速率;
(2)酸性条件下,亚硝酸钠具有氧化性,能将亚铁离子氧化为铁离子,自身被还原生成NO,所以反应Ⅱ中加入NaNO2的目的是氧化Fe2+,发生反应的离子方程式为 2H++Fe2++NO2-=Fe3++NO↑+H2O,
故答案为:2H++Fe2++NO2-=Fe3++NO↑+H2O;
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为 2Fe(OH)2++2H2O?Fe2(OH)42++2H+,
故答案为:2Fe(OH)2++2H2O?Fe2(OH)42++2H+;
(4)亚铁离子具有还原性,能被强氧化剂氧化生成铁离子,反应过程中颜色变化明显的效果最佳,
A.溴水为橙红色,溴将亚铁离子氧化为铁离子,溶液呈黄色,颜色变化不明显,故A不选;
B.KSCN溶液和亚铁离子不反应,没有颜色变化,故B不选;
C.NaOH溶液和亚铁离子反应生成白色沉淀,铁离子和氢氧根离子反应生成红褐色沉淀,掩盖氢氧化亚铁颜色,故C不选;
D.酸性KMnO4溶液呈紫色,亚铁离子能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,现象明显,故D选;
故答案为:D.
点评 本题考查物质的分离和提纯,侧重考查学生获取信息及利用信息能力、分析能力、实验操作能力,注意题给信息的灵活运用,知道常见离子的检验方法及现象,题目难度中等.


 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 步骤 | 操作 | 现象 |
| (1) | 向溶液中滴加稀盐酸 | 有刺激性气味气体产生 |
| (2) | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈橙色 |
| (3) | 向(2)所得的水溶液中加入Ba(NO3)2和稀HNO3 | 有白色沉淀产生 |
| (4) | 过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2是氧化剂,CO2是还原剂 | |
| B. | 若2molNa2O2完全反应,则反应中共转移了4mol电子 | |
| C. | 还原剂与氧化剂的质量比是1:1 | |
| D. | Na2O2中阳离子与阴离子的个数比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ①②③④⑤ | C. | ②③④⑤⑥ | D. | ①②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下溶解度比碳酸钠要大 | |
| B. | 热稳定性比碳酸钠要差 | |
| C. | 只能和酸反应不能和碱反应 | |
| D. | 和酸反应放出等量的二氧化碳,所消耗的酸比碳酸钠多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给试管内液体加热时,液体体积不应超过试管容积的$\frac{1}{3}$ | |
| B. | 过滤、蒸发操作过程中都需要用玻璃棒不断搅拌液体 | |
| C. | 测定某溶液的pH将干燥试纸浸入到待测溶液,过一会儿取出,与标准比色卡比较 | |
| D. | 用容量瓶配置一定物质的量浓度溶液时,容量瓶必须干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com