
| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm2 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
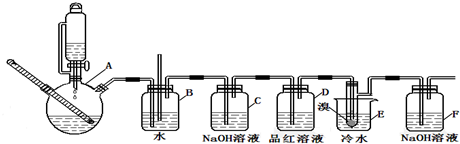
分析 (1)(2)(3)装置A中乙醇在浓硫酸做催化剂、脱水剂条件下发生消去反应生成乙烯,反应方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,b为安全瓶,可以防止倒吸,当c堵塞时,气体不畅通,则在b中气体产生的压强将水压入直玻璃管中,甚至溢出玻璃管,装置C中盛有氢氧化钠可以除去乙烯中二氧化硫、二氧化碳等的酸性气体,装置D中品红溶液验证二氧化硫是否被除尽,液溴易挥发,反应过程中应用冷水冷却装置E,能减少液溴挥发,E装置中乙烯与液溴发生加成反应生成1,2-二溴乙烷化学方程式为:CH2=CH2+Br2→CH2BrCH2Br,尾气中溴等有毒,能够污染大气,需要用F装置进行吸收;
(4)乙醇挥发、副反应发生或反应太剧烈等都导致无水乙醇消耗量超过理论值;
(5)乙烯和液溴均易溶于四氯化碳;
(6)制取的1,2-二溴乙烷可以进一步反应生成一种有机物,汽车常用该有机物作为防冻液,应是1,2-二溴乙烷再氢氧化钠水溶液、加热条件下发生水解反应生成乙二醇.
解答 解:装置A中乙醇在浓硫酸做催化剂、脱水剂条件下发生消去反应生成乙烯,反应方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,b为安全瓶,可以防止倒吸,当c堵塞时,气体不畅通,则在b中气体产生的压强将水压入直玻璃管中,甚至溢出玻璃管,装置C中盛有氢氧化钠可以除去乙烯中二氧化硫、二氧化碳等的酸性气体,装置D中品红溶液验证二氧化硫是否被除尽,液溴易挥发,反应过程中应用冷水冷却装置E,能减少液溴挥发,E装置中乙烯与液溴发生加成反应生成1,2-二溴乙烷化学方程式为:CH2=CH2+Br2→CH2BrCH2Br,尾气中溴等有毒,能够污染大气,需要用F装置进行吸收;
(1)制备乙烯的化学反应方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(2)C装置中的作用:除去乙烯中混有的酸性气体杂质,
故答案为:除去乙烯中混有的酸性气体杂质;
(3)反应过程中应用冷水冷却装置E,其主要目的是:减少液溴挥发,
故答案为:减少液溴挥发;
(4)乙醇挥发、副反应发生或反应太剧烈等都导致无水乙醇消耗量超过理论值,
故答案为:乙醇挥发、副反应发生或反应太剧烈;
(5)乙烯和液溴均易溶于四氯化碳,可以用四氯化碳吸收,
故答案为:是;乙烯和液溴均易溶于四氯化碳;
(6)制取的1,2-二溴乙烷可以进一步反应生成一种有机物,汽车常用该有机物作为防冻液,应是1,2-二溴乙烷再氢氧化钠水溶液、加热条件下发生水解反应生成乙二醇,反应方程式为:BrCH2BrCH2Br+2NaOH$→_{△}^{水}$HOCH2CH2OH+2NaBr,
故答案为:BrCH2BrCH2Br+2NaOH$→_{△}^{水}$HOCH2CH2OH+2NaBr;水解反应或取代反应.
点评 本题考查有机物制备实验,关键是理解制备原理与各实验装置作用,掌握实验制备基本则,熟练掌握有机物的结构与性质.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量的NaOH固体,Na2S溶液中的c(Na+)、c(S2-)均增大 | |
| B. | Na2S溶液中存在着:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | Na2S溶液中离子浓度关系为:c(Na+)>c(OH-)>c(S2-)>c(H+) | |
| D. | Na2S溶液中存在着:2c(Na+)=c(S2-)+c(HS-)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
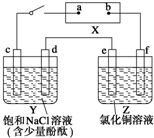 如图中X是直流电源.Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒.接通电路后,发现d附近显红色.
如图中X是直流电源.Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒.接通电路后,发现d附近显红色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{V•d}{MV+2240}$mol/L | B. | $\frac{M•V}{2240(V+0.1)d}$mol/L | ||
| C. | $\frac{100V•d•M}{MV+2240}$mol/L | D. | $\frac{1000V•d}{MV+2240}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仍在中间 | B. | 偏向左盘 | C. | 偏向右盘 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅与任何酸都不反应 | |
| B. | 二氧化碳通入水玻璃中能得到硅酸沉淀 | |
| C. | 硅的性质很稳定,能以单质形式存在于地壳中 | |
| D. | 二氧化硅溶于水显酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com