
25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ·mol-1、285.8 kJ·mol-1、890.3 kJ·mol-1、2 800 kJ·mol-1,则下列热化学方程式正确的是( )。
A.C(s)+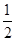 O2(g)=CO(g)ΔH=-393.5 kJ·mol-1 O2(g)=CO(g)ΔH=-393.5 kJ·mol-1 |
| B.2H2(g)+O2(g)=2H2O(g)ΔH=+571.6 kJ·mol-1 |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3 kJ·mol-1 |
D.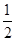 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)ΔH=-1 400 kJ·mol-1 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)ΔH=-1 400 kJ·mol-1 |
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:单选题
下列有关热化学方程式书写及对应表述均正确的是
| A.密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量。则Fe(s)+S(s)=FeS(s)△H=-95.6kJ/mol |
| B.稀醋酸与0.1 mol/LNaOH溶液反应:H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol |
| C.已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g)△H=+285.5kJ/mol |
| D.已知2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,则可知C的燃烧热△H=-110.5kJ/L |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)  CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )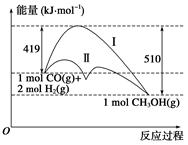
| A.该反应的ΔH=+91 kJ·mol-1 |
| B.加入催化剂,该反应的ΔH变小 |
| C.反应物的总能量大于生成物的总能量 |
| D.如果该反应生成液态CH3OH,则ΔH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:2SO2(g)+O2(g) 2SO3(g)ΔH="-197" kJ·mol-1。实验测得4 mol SO2参加上述反应放出354 kJ热量,则SO2的转化率最接近于( )
2SO3(g)ΔH="-197" kJ·mol-1。实验测得4 mol SO2参加上述反应放出354 kJ热量,则SO2的转化率最接近于( )
| A.90% | B.80% | C.50% | D.40% |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统。实验测得101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2气体,放出890.3 kJ的热量。下列热化学方程式书写正确的是( )
A.2H2(g)+O2(g) 2H2O(l) ΔH="-285.8" kJ/mol 2H2O(l) ΔH="-285.8" kJ/mol |
B.CH4(g)+2O2(g) CO2(g)+2H2O(l)ΔH="-890.3" kJ/mol CO2(g)+2H2O(l)ΔH="-890.3" kJ/mol |
C.CH4(g)+2O2(g) CO2(g)+2H2O(g)ΔH="-890.3" kJ/mol CO2(g)+2H2O(g)ΔH="-890.3" kJ/mol |
D.CH4(g)+2O2(g) CO2(g)+2H2O(l)ΔH="+890.3" kJ/mol CO2(g)+2H2O(l)ΔH="+890.3" kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于反应:C2H4(g)=C2H2(g)+H2(g),2CH4(g)=C2H4(g)+2H2(g),当升高温度时都向右移动。①C(s)+2H2(g)=CH4(g) ΔH1;②2C(s)+H2(g)=C2H2(g)ΔH2;③2C(s)+2H2(g)=C2H4(g) ΔH3。则①②③中ΔH1、ΔH2、ΔH3的大小顺序排列正确的是( )
| A.ΔH1>ΔH2>ΔH3 | B.ΔH2>ΔH3>ΔH1 | C.ΔH2>ΔH1>ΔH3 | D.ΔH3>ΔH2>ΔH1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是( )
| A.任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 |
| B.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
| C.已知:①2H2(g)+O2(g)=2H2O(g)ΔH=-a kJ·mol-1, ②2H2(g)+O2(g)=2H2O(l)ΔH=-b kJ·mol-1,则a>b |
| D.已知:①C(s,石墨)+O2(g)=CO2(g)ΔH=-393.5 kJ·mol-1, |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:①1 g氢气在氧气中完全燃烧生成气态水,放出热量120.9 kJ,②中和热为57.3 kJ·mol-1,③C(石墨s)=C(金刚石s) ΔH=+1.90 kJ·mol-1,下列说法正确的是( )。
| A.氢气的燃烧热为241.8 kJ·mol-1 |
| B.氢气燃烧的热化学方程式:2H2+O2=2H2O ΔH=-483.6 kJ·mol-1 |
| C.盐酸和氨水混合的热化学方程式:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1 |
| D.由③可知金刚石不及石墨稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com