
| A. | 卤素单质的最外层电子数都是7 | |
| B. | 从上到下,卤素原子的电子层数依次增多,半径依次减小 | |
| C. | 卤素单质与H2化合的容易程度为F2<Cl2<Br2<I2 | |
| D. | 从F到I,原子核对最外层电子的吸引能力依次减弱,原子得电子能力依次减弱,元素的非金属性依次减弱 |
分析 A.主族元素原子最外层电子数与其族序数相等,卤族单质中每个原子最外层都达到8电子结构;
B.原子电子层数越多,其原子半径越大;
C.元素的非金属性越强,其单质与氢气化合越容易;
D.原子半径越大,原子核对最外层电子的吸引力越小,原子失电子能力越强、得电子能力越弱.
解答 解:A.卤族元素单质中原子之间共用一个电子对,使每个原子都达到8电子稳定结构,故A错误;
B.原子电子层数越多,其原子半径越大,所以卤族元素从上到下,卤素原子的电子层数依次增多,半径依次增大,故B错误;
C.元素的非金属性越强,其单质与氢气化合越容易,从F到I,元素的非金属性逐渐减弱,其单质的氧化性逐渐减弱,所以卤素单质与H2化合的容易程度为F2>Cl2>Br2>I2,故C错误;
D.原子半径越大,原子核对最外层电子的吸引力越小,原子失电子能力越强、得电子能力越弱,元素得电子能力越弱其非金属性越弱,所以从F到I,原子核对最外层电子的吸引能力依次减弱,原子得电子能力依次减弱,元素的非金属性依次减弱,故D正确;
故选D.
点评 本题考查同一主族元素性质递变规律,为高考高频点,明确结构和性质的关系即可解答,知道非金属性强弱判断方法、金属性强弱判断方法,熟练掌握同一主族、同一周期元素性质递变规律.


科目:高中化学 来源: 题型:解答题
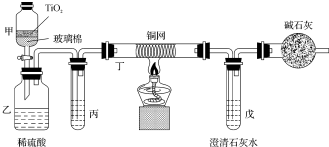
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{4b-2a}{V}$ | B. | (2b-2a)/V | C. | (2b-a)/V | D. | (b-2a)/V |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
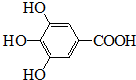 300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水.没食子酸的结构式为:
300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水.没食子酸的结构式为: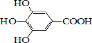 +4NaOH→
+4NaOH→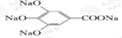 +4H2O.
+4H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 可简化为:
可简化为: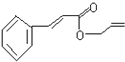 杀虫剂“阿乐丹”的结构表示为:
杀虫剂“阿乐丹”的结构表示为: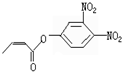 ,它在稀酸作用下能发生水解反应生成两种有机物.下列关于这两种有机物的共同性质叙述不正确的是( )
,它在稀酸作用下能发生水解反应生成两种有机物.下列关于这两种有机物的共同性质叙述不正确的是( )| A. | 遇FeCl3溶液均显紫色 | B. | 均能发生氧化反应 | ||
| C. | 均能与溴水发生反应 | D. | 均能与NaOH溶液发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 据报道,某些花岗岩会产生放射性的氡(${\;}_{86}^{222}$Rn),从而对人体产生伤害.请回答:
据报道,某些花岗岩会产生放射性的氡(${\;}_{86}^{222}$Rn),从而对人体产生伤害.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 混合物 | 试剂 | 分离方法 | |
| A | 溴苯(溴) | 氢氧化钠溶液 | 过滤 |
| B | 苯(甲苯) | 酸性高锰酸钾溶液 | 分液 |
| C | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
| D | 溴乙烷(乙醇) | 蒸馏水 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X:3s23p1 Y:3s23p5 | B. | X:3d64s2 Y:2s22p4 | ||
| C. | X:3s23p2 Y:2s22p4 | D. | X:3s2 Y:2s22p3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
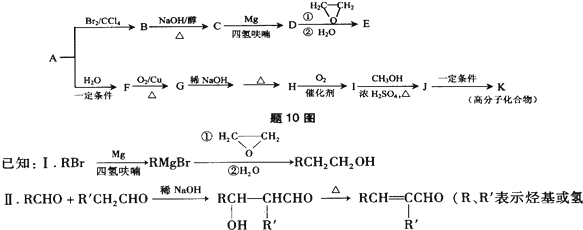
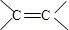 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com