
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
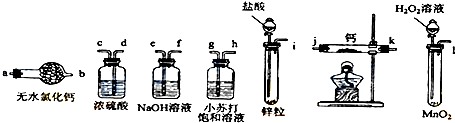
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
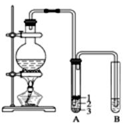 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④③② | B. | ④③②① | C. | ②③④① | D. | ①④②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | I A | II A | III A | IV A | V A | VI A | VII A | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
 ;钙离子的电子式为:Ca2+.
;钙离子的电子式为:Ca2+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
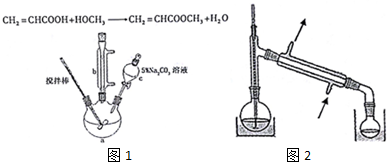
| 沸点 | 溶解性 | ||
| 丙烯酸 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
| 甲醇 | 65℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
| 丙烯酸丙烯酸甲酯 | 80.5℃ | 难溶于水易溶于有机溶剂 | 易挥发 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com