目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.
(1)配合物Ni(CO)
4常温为液态,易溶于CCl
4、苯等有机溶剂.固态Ni(CO)
4属于
晶体;基态Ni原子的电子排布式为
,写出与CO互为等电子体的一种离子的化学式为
.
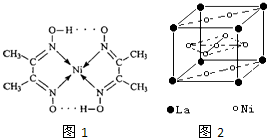
(2)如图1配合物分子内的作用力除共价键外,还存在的两种作用力是
(填编号).
A.氢键 B.离子键 C.范德华力 D.配位键
(3)很多不饱和有机物在Ni催化下可以与H
2发生加成反应.
如:①CH
2=CH
2、②CH≡CH、③
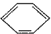
、④HCHO等,其中碳原子采取sp
2杂化的分子有
(填物质序号),HCHO分子的立体结构为
形.
(4)Mn、Fe和Ni一样均为第四周期过渡元素,两元素的部分电离能数据如下表.
| 元 素 | Mn | Fe |
电离能
/kJ?mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 |
| I3 | 3248 | 2957 |
据此分析Mn
2+比Fe
2+
(填“更易”或“更难”)再失去-个电子,从微粒结构的角度简述其原因是
.
(5)NiO的晶体结构类型与氯化钠的相同,NiO晶胞中与Ni最近的Ni的数目为
个.
(6)氢气是新型清洁能源,镧(La)和镍的合金可做储氢材料.该合金的晶胞如图2所示,晶胞中心有一镍原子,其他镍原子都在晶胞面上.该晶体的化学式是
.



 ④CH3COONH4 ⑤NH4HCO3
④CH3COONH4 ⑤NH4HCO3 >HCO3-.常温下,物质的量浓度相同的①、②、③溶液pH由大到小顺序为(填序号)
>HCO3-.常温下,物质的量浓度相同的①、②、③溶液pH由大到小顺序为(填序号) 目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力. 、④HCHO等,其中碳原子采取sp2杂化的分子有
、④HCHO等,其中碳原子采取sp2杂化的分子有