
【题目】兴趣小组设计实验,测定![]() 与
与![]() 混合物中
混合物中![]() 的质量分数.
的质量分数.
甲方案:
实验步骤为:
![]() 称量空坩埚的质量为
称量空坩埚的质量为![]() ;
;![]() 称量装有试样的坩埚质量为
称量装有试样的坩埚质量为![]() ;
;
![]() 加热;
加热;
![]() 冷却;
冷却;
![]() 称量坩埚和残余物的质量为
称量坩埚和残余物的质量为![]() ;
;
![]() 重复
重复![]() 至
至![]() 操作,直至恒重,质量为
操作,直至恒重,质量为![]() 。
。
(1)坩埚中发生反应的化学方程式___________________________。
(2)计算![]() 质量分数为 _____________________________
质量分数为 _____________________________![]() 表达式
表达式![]() 。
。
乙方案:
准确称取![]() 样品,放锥形瓶中,加入适量水溶解,滴入2滴酚酞试液,用
样品,放锥形瓶中,加入适量水溶解,滴入2滴酚酞试液,用![]() 的标准盐酸滴定至溶液由粉红色刚好变为无色,达到滴定终点时产物为
的标准盐酸滴定至溶液由粉红色刚好变为无色,达到滴定终点时产物为![]() ,即
,即![]() 。重复上述操作两次。
。重复上述操作两次。
![]() 配制上述盐酸标准溶液100ml,若用
配制上述盐酸标准溶液100ml,若用![]() 进行配制,需用量筒量取该HCl溶液________ml;定容时俯视刻度线,将导致配制的溶液浓度________。
进行配制,需用量筒量取该HCl溶液________ml;定容时俯视刻度线,将导致配制的溶液浓度________。![]() 填“偏高”、“偏低”或“没有影响”
填“偏高”、“偏低”或“没有影响”![]()
(4)根据下表数据,样品中![]() _________。
_________。![]() 保留三位有效数字
保留三位有效数字![]()
滴定次数 | 样品的质量 | 稀盐酸的体积 | |
滴定前刻度 | 滴定后刻度 | ||
1 |
|
|
|
2 |
|
|
|
3 |
|
|
|
丙方案:称取![]() 样品,选用下图部分装置测定样品与硫酸反应生成的气体体积。
样品,选用下图部分装置测定样品与硫酸反应生成的气体体积。

(5)某同学按以下方法检查装置A的气密性:在分液漏斗中加入适量水,如图连接好装置,关闭止水夹a,用止水夹夹住橡皮管c,打开活塞b。若分液漏斗中的水无法持续滴下,试判断装置A是否漏气?________![]() 填“漏气”、“不漏气”或“无法确定”
填“漏气”、“不漏气”或“无法确定”![]() 。实验时,装置A中c的作用_____________________,________________。
。实验时,装置A中c的作用_____________________,________________。
(6)为了提高测定的准确性,应选用装置A和_____![]() 填写字母标号
填写字母标号![]() 进行实验。
进行实验。
【答案】![]()
![]()
![]()
![]()
![]() 偏高
偏高 ![]() 无法确定 平衡气压,有利于液体流出 减小由于液体流下引起的体积误差 C
无法确定 平衡气压,有利于液体流出 减小由于液体流下引起的体积误差 C
【解析】
(1)Na2CO3与NaHCO3混合物中碳酸氢钠受热分解生成碳酸钠、二氧化碳和水;
(2)依据加热反应过程中反应前后质量变化计算碳酸氢钠质量,进而得到碳酸钠质量,可以计算出碳酸钠质量分数;
(3)根据溶液稀释过程中溶质氯化氢的量守恒可计算出盐酸的体积,定容时俯视刻度线,将导致配制的溶液的体积偏小,据此判断;
(4)滴定实验利用酚酞指示终点,发生的反应为:H++CO32-=HCO3-,依据反应定量关系计算得到碳酸钠物质的量,计算得到碳酸钠质量分数;
(5)在分液漏斗中加入适量水,如图连接好装置,关闭止水夹a,用止水夹夹住橡皮管c,打开活塞b,若装置不漏气,由于分液漏斗上面容器中压强小,里面的液体不能完全流下,导管c连接分液漏斗和蒸馏烧瓶,使两容器中压强相等,同时减小液体流下引起气体体积误差;
(6)为了提高测定的准确性,测量气体体积应选用量气管更准确。
(1)Na2CO3与NaHCO3混合物中碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,坩埚中发生反应的化学方程式为:2NaHCO3![]() Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;
故答案为:2NaHCO3![]() Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;
(2)①称量空坩埚的质量为Ag;②称量装有试样的坩埚质量为Bg;③加热;④冷却;⑤称量坩埚和残余物的质量为Cg;⑥重复③至⑤操作,直至恒重,质量为Dg,依据计算方法分析,需要的数值为:①称量空坩埚的质量为Ag;②称量装有试样的坩埚质量为Bg;③加热;④冷却,称量至恒重得到反应后固体质量,则反应前后质量差为=B-D,结合反应:
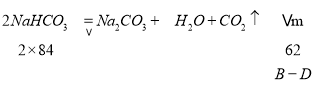
前后固体质量差计算混合物中碳酸氢钠的质量=![]() ,碳酸钠质量为BA碳酸氢钠质量,计算得到碳酸钠质量质量分数=
,碳酸钠质量为BA碳酸氢钠质量,计算得到碳酸钠质量质量分数=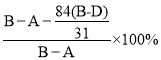 =
=![]() ;
;
(3)根据溶液稀释过程中溶质氯化氢的量守恒:0.1000mol/L×100mL=2.0mol/L×V2,可计算出盐酸的体积V2=![]() =5.0mL,定容时俯视刻度线,将导致配制的溶液的体积偏小,所以会导致溶液的浓度偏高;
=5.0mL,定容时俯视刻度线,将导致配制的溶液的体积偏小,所以会导致溶液的浓度偏高;
(4)图表中盐酸溶液体积平均为:![]() mL=20.00mL
mL=20.00mL
根据反应
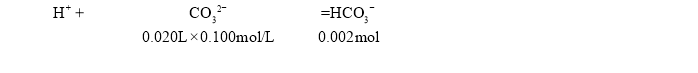 m(Na2CO3)=0.002mol×106g/mol=0.212g,
m(Na2CO3)=0.002mol×106g/mol=0.212g,
碳酸钠质量分数=![]() ×100%=70.7%;
×100%=70.7%;
(5)在分液漏斗中加入适量水,如图连接好装置,关闭止水夹a,用止水夹夹住橡皮管c,打开活塞b,若装置不漏气,由于分液漏斗上面容器中压强小,里面的液体不能完全流下,其现象是水流下一段时间后不再流出,且持续一段时间;在分液漏斗中加入适量水,如图连接好装置,关闭止水夹a,用止水夹夹住橡皮管c,打开活塞b,若分液漏斗中的水无法持续滴下不能判断装置气密性,可能是分液漏斗上口凹槽未对应玻璃活塞的凹槽;导管c连接分液漏斗和蒸馏烧瓶,使两容器中压强相等,便于分液漏斗中的液体流下,同时减小液体流下引起气体体积误差;
(6)为了提高测定的准确性,测量气体体积应选用量气管更准确,应选择AC装置进行测定。


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
【题目】坦桑石是一种世界公认的新兴宝石,这种宝石于1967年首次在赤道雪山脚下的阿鲁沙地区被发现。坦桑石的主要化学成分为![]() ,还可含有V、Cr、Mn等元素。
,还可含有V、Cr、Mn等元素。
![]() 下列状态的铝中,电离最外层的一个电子所需能量最大的是________
下列状态的铝中,电离最外层的一个电子所需能量最大的是________![]() 填序号
填序号![]() 。
。
①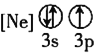 ②
②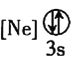 ③
③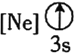 ④
④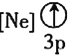
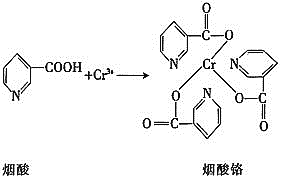
![]() 烟酸铬是铬的一种化合物,其合成过程如下:
烟酸铬是铬的一种化合物,其合成过程如下:
![]() 核外电子排布式为________。
核外电子排布式为________。
![]() 、C、N、O的电负性由大到小的顺序是_________。
、C、N、O的电负性由大到小的顺序是_________。
![]() 烟酸中碳、氮原子的杂化方式分别为________、________。
烟酸中碳、氮原子的杂化方式分别为________、________。
![]() 分子中的大
分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数
键的电子数![]() 如二氧化碳分子中的大
如二氧化碳分子中的大![]() 键可表示为
键可表示为![]() ,则烟酸中的大
,则烟酸中的大![]() 键应表示为___________。
键应表示为___________。
![]() 、
、![]() 都极易水解。
都极易水解。![]() 、
、![]() 都属于______
都属于______![]() 填“极性”或“非极性”
填“极性”或“非极性”![]() 分子,其熔点的关系为
分子,其熔点的关系为![]() ________
________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 将Mn掺入GaAs晶体
将Mn掺入GaAs晶体![]() 图甲
图甲![]() 可得到稀磁性半导体材料
可得到稀磁性半导体材料![]() 图乙
图乙![]() ,图甲、图乙晶体结构不变。
,图甲、图乙晶体结构不变。
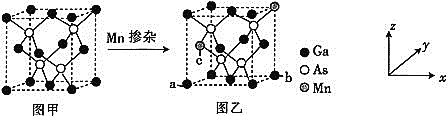
![]() 图乙中a点和b点的原子坐标参数分别为
图乙中a点和b点的原子坐标参数分别为![]() 0,
0,![]() 和
和![]() 1,
1,![]() ,则c点的原子坐标参数为________。
,则c点的原子坐标参数为________。
![]() 设图甲晶体的密度为
设图甲晶体的密度为![]() ,用
,用![]() 表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个镓原子之间的距离为________________pm。
表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个镓原子之间的距离为________________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水仙花所含的挥发油中含有丁香油酚、苯甲醇、苯甲醛、桂皮醇等成分。它们的结构简式如下:
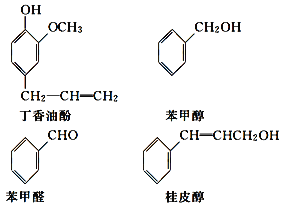
请回答下列问题:
(1)①丁香油酚中含氧的官能团是_____;丁香油酚可能具有的性质是_____(填字母)。
A.可与烧碱反应
B.只能与Br2发生加成反应
C.既可燃烧,也可使酸性KMnO4溶液褪色
D.可与NaHCO3溶液反应放出CO2气体
②从结构上看,上述四种有机物中与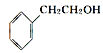 互为同系物的是____(填名称)。
互为同系物的是____(填名称)。
(2)苯甲醛经________(填反应类型)反应可得到苯甲醇。写出苯甲醛和银氨溶液反应化学方程式为___________________________________。III
(3)由桂皮醇转化为丙的过程为(已略去无关产物)
桂皮醇![]()
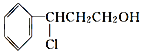
![]() 甲
甲![]() 乙
乙![]() 丙
丙
如果反应Ⅱ为消去反应,则反应Ⅱ的条件是_______________,反应Ⅲ为加聚反应,则高聚物丙的结构简式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A. 使pH试纸显蓝色的溶液中:Na+、Mg2+、ClO-、HSO3-
B. c(Fe3+)=0.1 mol·L-1的溶液中:K+、NH4+、SO42-、SCN-
C. ![]() =0.1 mol·L-1的溶液中:Na+、HCO3-、K+、NO3-
=0.1 mol·L-1的溶液中:Na+、HCO3-、K+、NO3-
D. 0.1 mol·L-1的NaHCO3溶液中:NH4+、NO3-、Na+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.无色溶液中:Al3+、NH4+、Cl-、S2-
B.使酚酞显红色的溶液中:Na+、ClO-、CO32-、NO3-
C.0.1mol·L-1FeCl3溶液中:Mg2+、NH4+、SCN-、SO42-
D.由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Fe2+、Cu2+、SO42-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:K+、NH4+、S2-、ClO-
B.与Al反应能产生H2的溶液中:Na+、Cu2+、NO3-、I-
C.使甲基橙变红的溶液:Na+、NH4+、SO32-、Cl-
D.![]() =1×10-12的溶液:K+、AlO2-、CO32-、Na+
=1×10-12的溶液:K+、AlO2-、CO32-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用作风信子等香精的定香剂D以及可用作安全玻璃夹层的高分子化合物PVB的合成路线如下:
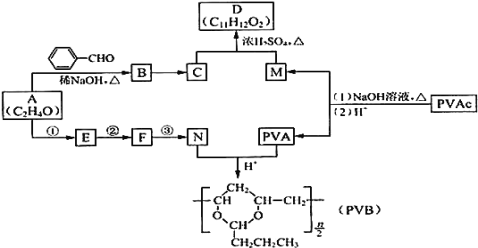
已知:Ⅰ.RCHO+R’CH2CHO![]()
![]() +H2O(R、R’表示烃基或氢)
+H2O(R、R’表示烃基或氢)
Ⅱ.醛与二元醇![]() 如:乙二醇
如:乙二醇![]() 可生成环状缩醛:RCHO+HOCH2CH2OH
可生成环状缩醛:RCHO+HOCH2CH2OH![]()
 +H2O
+H2O
⑴A的核磁共振氢谱有两种峰.A的名称是 ______
⑵下列关于B的说法正确的是 ______
a.分子式为C9H8O b.所有原子均可在同一平面上
c.最多可以与5molH2发生反应 d.可以使溴水褪色
⑶C为反式结构,由B还原得到。C的结构简式是 ______
⑷G与D含有相同的官能团,相对分子量比D小28,则G的结构有 ______ 种![]() 不包括立体异构
不包括立体异构![]()
⑸E能使Br2的CCl4溶液褪色,N由A经反应①③合成。
a.②的反应类型是 ______
b.③的化学方程式是 ______
⑹PVAc由一种单体经加聚反应得到,该单体的结构简式是 ______
⑺碱性条件下,PVAc完全水解的化学方程式是 ______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼![]() 是无色、有强还原性的液体,实验室制备水合肼的原理为
是无色、有强还原性的液体,实验室制备水合肼的原理为![]() 据此,某学生设计了下列实验.
据此,某学生设计了下列实验.
(制备NaClO溶液)实验装置如图甲所示![]() 部分夹持装置已省略
部分夹持装置已省略![]()
已知:3NaClO![]()
![]()
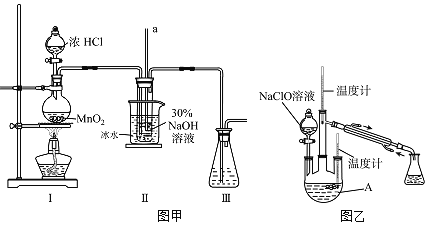
(1)配制![]() 溶液时,所需玻璃仪器除量筒外还有______
溶液时,所需玻璃仪器除量筒外还有______![]() 填字母
填字母![]() 。
。
A.容量瓶![]() 烧杯
烧杯![]() 移液管
移液管![]() 玻璃棒
玻璃棒
(2)装置Ⅰ中发生的离子反应方程式是______;Ⅱ中玻璃管a的作用为______;为了提高NaClO的产率,需对Ⅰ中产生的![]() 进行净化,所用试剂是______;Ⅱ中用冰水浴控制温度在
进行净化,所用试剂是______;Ⅱ中用冰水浴控制温度在![]() 以下,其主要目的______。
以下,其主要目的______。
(制取水合肼)实验装置如图乙所示
(3)仪器A的名称为______;反应过程中,如果分液漏斗中溶液的滴速过快,部分![]() 参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式______;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。
参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式______;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。
(测定肼的含量)
(4)称取馏分![]() ,加水配成
,加水配成![]() 溶液,在一定条件下,用
溶液,在一定条件下,用![]() 的
的![]() 溶液滴定.已知:
溶液滴定.已知:![]()
![]() 滴定时,可以选用的指示剂为______;
滴定时,可以选用的指示剂为______;
![]() 实验测得消耗
实验测得消耗![]() 溶液的平均值为
溶液的平均值为![]() ,馏分中
,馏分中![]() 的质量分数为______。
的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A与![]() 、CO形成B,B能发生银镜反应,C分子中只有一种氢,相关物质转化关系如下
、CO形成B,B能发生银镜反应,C分子中只有一种氢,相关物质转化关系如下![]() 含有相同官能团的有机物通常具有相似的化学性质
含有相同官能团的有机物通常具有相似的化学性质![]() :
:
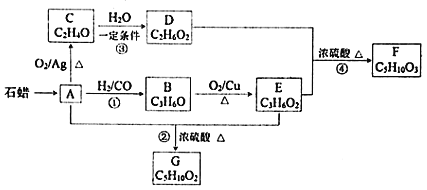
请回答:
![]() 有机物C的结构简式是______,反应②的反应类型是______。
有机物C的结构简式是______,反应②的反应类型是______。
![]() 写出一定条件下发生反应①的化学方程式______。
写出一定条件下发生反应①的化学方程式______。
![]() 下列说法不正确的是______
下列说法不正确的是______![]() 填字母
填字母![]() 。
。
A.化合物A属于烃
B.化合物D含有两种官能团
C.用金属钠无法鉴别化合物F、G
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com