

| A. | 离子半径:M->Z2->Y- | |
| B. | 气态氢化物稳定性:Y>Z>M | |
| C. | Z元素形成的氧化物都是共价化合物 | |
| D. | 三种元素中,Y的最高价氧化物对应的水化物酸性最强 |
分析 由短周期元素在周期表中的位置可知,X为He、Y为F、M为Cl、Z为S.
A.电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大;
B.非金属性越强,氢化物越稳定;
C.非金属性氧化物属于共价化合物;
D.高氯酸是酸性最强含氧酸.
解答 解:由短周期元素在周期表中的位置可知,X为He、Y为F、M为Cl、Z为S,
A.电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->Cl->F-,故A错误;
B.非金属性Y>M>Z,故氢化物越稳定Y>M>Z,故B错误;
C.二氧化硫、三氧化硫都是非金属性氧化物,属于共价化合物,故C正确;
D.高氯酸是酸性最强含氧酸,故D错误,
故选C.
点评 本题考查元素周期表与元素周期律,难度不大,注意掌握元素周期律及微粒半径比较规律.


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:解答题
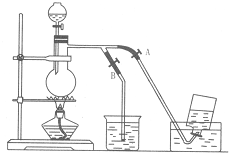 如图表示在没有通风橱收纯净的氯气时设计的装置,图中A、B是可控制的弹簧铁夹.
如图表示在没有通风橱收纯净的氯气时设计的装置,图中A、B是可控制的弹簧铁夹. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCl2+Ca(OH)2═CaCl2+Mg(OH)2↓ | B. | Mg(OH)2+2HCl═MgCl2+2H2O | ||
| C. | Mg(OH)2+H2SO4═MgSO4+2H2O | D. | MgCl2$\frac{\underline{\;通电\;}}{熔融}$Mg+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提倡人们购物时尽量不用塑料袋,是为了减少白色污染 | |
| B. | 凡含有食品添加剂的食物对人体健康均有害,均不可食用 | |
| C. | 推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用 | |
| D. | 为防止电池中的重金属污染土壤和水体,应积极开发废电池的综合使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸 | |
| B. | 0.1mol•L-1的NaHCO3溶液中C(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-) | |
| C. | 0.1mol•L-1的NaHA溶液pH=5,则溶液:c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-) | |
| D. | pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使酸性KMnO4溶液褪色 | |
| B. | 乙烯使溴水褪色 | |
| C. | 苯和浓硝酸、浓硫酸混合液在50-60℃水溶中发生的反应 | |
| D. | 将苯滴入溴水中,振荡后水层接近无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| B. | 0.01mol/L NH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH- $→_{△}^{NaOH}$ CH2BrCOO-+H2O | |
| D. | 用稀氢氧化钠溶液吸收二氧化氮:2OH-+2NO2=NO3-+NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com