

分析 由生产流程可知,先从铝土矿获得氧化铝,利用NaOH溶解后、再通入足量二氧化碳生成氢氧化铝,然后加热氢氧化铝生成氧化铝,再电解熔融的氧化铝可得到Al单质,电解时阳极生成氧气,阴极生成Al,以此来解答.
解答 解:(1)从铝土矿获得氧化铝涉及的反应为Al2O3(铝土矿)+2NaOH═2NaAlO2+H2O、NaAlO2+2H2O+CO2=Al(OH)3↓+NaHCO3、2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,
故答案为:Al2O3(铝土矿)+2NaOH═2NaAlO2+H2O、NaAlO2+2H2O+CO2=Al(OH)3↓+NaHCO3、2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O;
(2)Al为活泼金属,电解铝时的电解质为氧化铝-冰晶石熔融液,常加入少量氯化钙的目的是降低熔点,
故答案为:氧化铝-冰晶石熔融液;降低熔点;
(3)电解铝时阳极反应为6O2--12e-=3O2↑,阴极反应为4Al3++12e-=4Al,阳极碳块需要定期更换,其原因是阳极产生的氧气与阳极材料中的碳发生反应,
故答案为:6O2--12e-=3O2↑;4Al3++12e-=4Al;阳极产生的氧气与阳极材料中的碳发生反应;
(4)电解铝生产1mol铝时消耗电能2.2×106J,槽电压为4.0V,一个电子的电量为1.6×10-19C,由Al3++3e-=Al可知,则铝电解时电能利用率为$\frac{1mol×3×6.02×1{0}^{23}×1.6×1{0}^{-19}×4}{2.2×1{0}^{6}}$×100%=52.54%,故答案为:52.54%.
点评 本题考查铝的冶炼及混合物分离提纯、电解原理等,为高频考点,把握流程中的反应及电解原理为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol•L-1的醋酸溶液中含有0.1NA个H+ | |
| B. | 1L1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| C. | 25℃时,1LpH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| D. | 1mol单质硅含有2NA个Si-Si键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 8种 | C. | 10种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | 键能/(kJ•mol-1) | 化学键 | 键能/(kJ•mol-1) |
| H-H | 436.0 | I-I | 153 |
| O=O | 497.0 | N=N | 946 |
| O-H | 463.0 | H-I | 297 |
| N-H | 391.0 |
| A. | 氢气的燃烧热为△H=-483kJ/mol | |
| B. | H2(g)+I2(g)$\frac{200℃}{\;}$2HI(g)△H=-5kJ/mol | |
| C. | N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol | |
| D. | 在相同条件下,等量的氢气完全燃烧和与氧气组成燃烧电池时,焓变相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 编号 | ① | ② | ③ | ④ |
| 稀硝酸的体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属的质量/g | 18.0 | 9.6 | 0 | 0 |
| NO的体积/mL | 2240 | 4480 | 6720 | V |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

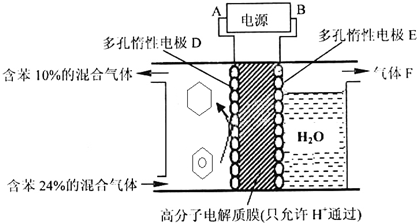
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为便于观察铁在氯气中燃烧的现象,加大氯气的使用量 | |
| B. | 用小铜粒代替可调节高度的铜丝 进行铜和浓硝酸反应的实验 | |
| C. | 焚烧塑料、橡胶等废弃物是处理城市生产、生活垃圾的有效方法 | |
| D. | 用加热H2O2、稀H2SO4和Cu代替加热浓H2SO4和Cu制取CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
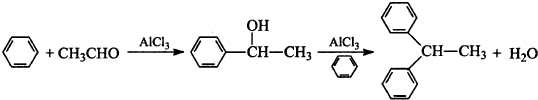
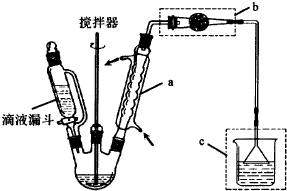
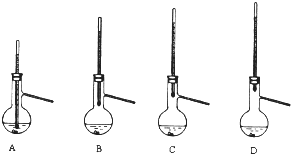
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com