
| A. | $\stackrel{235}{92}$U和$\stackrel{238}{92}$U是中子数不同质子数相同的同种核素 | |
| B. | 质子数为53,中子数为78的碘原子:$\stackrel{131}{53}$I | |
| C. | 同种元素的原子均有相同的质子数和中子数 | |
| D. | 通过化学变化可以实现16O与18O间的相互转化 |
分析 A.核素的种类由质子数和中子数决定,质子数相同中子数不同的同一元素互称同位素;
B.原子符号的左上角的数字是质量数,左下角的数字是质子数,质子数+中子数=质量数;
C.同种元素的不同核素质子数相同,中子数不同;
D.同位素之间的转化属于核变化.
解答 解:A.$\stackrel{235}{92}$U和$\stackrel{238}{92}$U是同种元素U的不同核素,质子数相同,中子数不同,互为同位素,故A错误;
B.质子数+中子数=质量数,故质子数为53、中子数为78的碘原子中质量数为131,标在原子符号的左上角,质子数标在左下角,碘原子原子符号为:$\stackrel{131}{53}$I,故B正确;
C.同种元素的不同核素质子数相同,中子数不同,如$\stackrel{235}{92}$U和$\stackrel{238}{92}$U,故C错误;
D.16O与18O间的相互转化没有新物质生成,属于核变化,故D错误;
故选B.
点评 本题考查原子符号含义、同位素等,为高频考点,难度不大.把握化学用语的规范应用是解答的关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
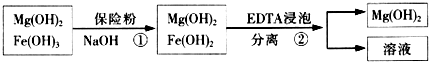
| 精制阻燃剂的条件 | 阻燃剂铁含量 | |||
| 序号 | 提纯体系温度/℃ | 加入EDTA质量/g | 加入保险粉质量/g | W(Fe)/(10-4g) |
| 1 | 40 | 0.05 | 0.05 | 7.63 |
| 2 | 40 | 0.05 | 0.10 | 6.83 |
| 3 | 60 | 0.05 | 0.10 | 6.83 |
| 4 | 60 | 0.10 | 0.10 | 6.51 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
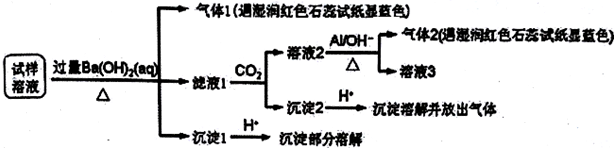
| A. | 试样中肯定存在NH4+、Mg2+、SO42-和NO3- | |
| B. | 该雾霾中可能存在NaNO3、NH4Cl和MgSO4 | |
| C. | 试样中可能存在Na+、Cl- | |
| D. | 试样中一定不含Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
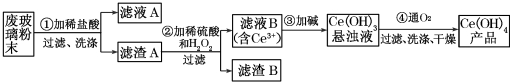
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c(C{H}_{3}COOH)}{c(O{H}^{-})}$ | B. | $\frac{c(O{H}^{-})}{c({H}^{+})}$ | C. | c(H+)和c(OH-)的乘积 | D. | OH-的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
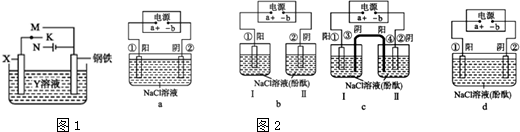
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B位于元素周期表中第二周期第ⅥA族 | |
| B. | 工业上可以用电解CE溶液的方法同时获得C、E单质 | |
| C. | C、D的最高价氧化物对应的水化物之间能发生化学反应 | |
| D. | 化合物AE与CE具有相同类型的化学键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com