
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(福建卷解析版) 题型:填空题
[化学—物质结构与性质]
(1)依据第2周期元素第一电离能的变化规律,参照下图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置。

(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2 NF3+3NH4F
NF3+3NH4F
①上述化学方程式中的5种物质所属的晶体类型有_________(填序号)。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
②基态铜原子的核外电子排布式为________。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:

①晶体Q中各种微粒间的作用力不涉及___________(填序号)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②R中阳离子的空间构型为_______,阴离子的中心原子轨道采用_______杂化。
(4)已知苯酚( )具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子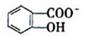 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:
为了解释和预测分子的空间构型,科学家在归纳了许多已知的分子空间构型的基础上,提出了一种十分简单的理论模型――价层电子对互斥模型。这种模型把分子分成两类:一类是 ;另一类是 。BF3和NF3都是四个原子的分子,BF3的中心原子是 ,NF3的中心原子是 ;BF3分子的立体构型是平面三角形,而NF3分子的立体构型是三角锥形的原因是
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com