
 25℃时,已知某些物质的电离平衡常数如表:
25℃时,已知某些物质的电离平衡常数如表:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
| c(H+) |
| c(CH3COOH) |
| c(OH-) |
| c(H+) |


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:
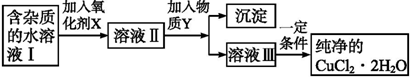
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 有机物A和B均由C、H、O三种元素组成,A、B互为同分异构体,均在酸性条件下水解,且均只生成两种有机物.下列说法正确的是( )
有机物A和B均由C、H、O三种元素组成,A、B互为同分异构体,均在酸性条件下水解,且均只生成两种有机物.下列说法正确的是( )| A、X、Y一定互为同系物 |
| B、X、Y的通式一定不相同 |
| C、X、Y一定互为同分异构体 |
| D、X、Y可能互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、定容时仰视容量瓶的刻度线 |
| B、容量瓶没有烘干 |
| C、托盘天平的砝码生锈 |
| D、定容时加水多后用滴管吸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(B) |
| c(OH-) |
| c(OH-) |
| c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com