
【题目】固体NH5属于离子晶体。它与水反应的化学方程式为NH5+H2O→NH3·H2O+H2↑,它也能跟乙醇发生类似的反应,并都产生氢气。下列有关NH5叙述正确的是
A.含有NH4+和H-
B.NH5中N元素的化合价为+5价
C.1 mol NH5中含有5NA个N—H键
D.与乙醇反应时,NH5被还原
科目:高中化学 来源: 题型:
【题目】CO和CO2的混合气体36g,完全燃烧后测得CO2的体积为22.4 L(标准状况下)。
(1)求混合气体中CO的质量。
(2)混合气体中CO2在标准状况下的体积。
(3)混合气体在标准状况下的密度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示。下列说法正确的是( )

A.燃料电池工作时,正极反应为O2+2H2O+4e-=4OH-
B.此装置用于铁表面镀铜时,a为铁b为Cu,工作一段时间要使右池溶液复原可加入适量的CuO
C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D.若a、b两极均为石墨时,在相同条件下,a极产生的气体与电池中消耗的H2体积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]利用元素周期表中同族元素的相似性,可预测元素的性质。
(1)写出P元素的基态原子的核外电子排布式:__________,P元素的基态原子有_________个未成对电子。
(2)白磷的分子式为P4,其结构如下图所示。
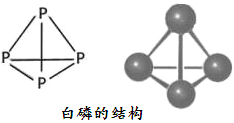
科学家目前合成了 N4分子,在N4分子中N原子的杂化轨道类型是___________,N—N键的键角为_____________
(3)N、P、As原子的第一电离能由大到小的顺序为_____________。
(4)立方氮化硼晶体的结构如下图所示:
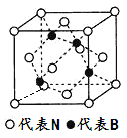
立方氮化硼晶体中,每个晶胞中B原子的个数为_____________。
(5)N与As是同族元素,B与Ga是同族元素,立方砷化镓晶体与立方氮化硼晶体结构类似,两种晶体中熔点较高的是____________;立方砷化镓晶体的晶胞边长为a pm(1pm=1×10-12m),则其密度为____________g·cm-3(用含a的式子表示,设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.用铜作电极电解饱和食盐水:2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
B.Fe3O4与过量的稀HNO3反应: Fe3O4+8H+ Fe2++2Fe3++4H2O
C.向Ba(OH)2 溶液中逐滴加入NaHSO4溶液至Ba2+刚好沉淀完全:
Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.NaHS溶液呈碱性:HS-+H2O![]() H3O++OH-+S2-
H3O++OH-+S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种电池的正极材料,可通过下列方法制得:
①称取一定量的固体铁氧体磁性材料溶于过量盐酸,接着先后加入双氧水和氢氧化钠溶液,静置24 h,过滤
②将沉淀加入反应瓶中,加入过量的氢氟酸溶液,80'c恒温加热24 ha
③蒸发多余氢氟酸和水,得淡红色FeF3凝胶
④在干燥箱中,以100℃预处理6 h,最后掺入铁氧体磁性材料混合研磨制得正极材料
(1)加入双氧水的作用是______(用离子方程式表示)
(2)步骤②的反应瓶材质可能是____(填序号)
A.玻璃 B.陶瓷 C.聚四氟乙烯
(3)加氢氟酸反生反应的化学方程式为____
(4)从安全的角度考虑,在实验室里制三氟化铁时应在____中进行
(5)三氟化铁与Li在固体电解质铁氧体中发生置换反应,产生的电流可供电脑使用,该电池反应的化学方程式为________
(6)取上述铁氧体样品溶于足量盐酸,在通入标准状况下672 mL C12, Fe2+恰好被完全氧化成Fe3十,然后把溶液蒸干,灼烧至恒重得9. 6 g固体,则该铁氧体的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池总反应的离子方程式是: Zn+Cu2+===Zn2++Cu,依据此反应设计原电池的正确组合是
选项 | 正极 | 负极 | 电解质溶液 |
A | Cu | Zn | 稀盐酸 |
B | C | Zn | 硫酸铜溶液 |
C | Zn | Cu | 氯化铜溶液 |
D | Zn | Cu | 硝酸铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)N2、CO2、SO2三种气体的物质的量比为1∶1∶1时,它们的分子个数比为___________;质量比为___________;同温、同压下体积之比为___________。
(2) 同温同压下,质量相同的四种气体: ① CO2 ② H2 ③ O2 ④ CH4
所占的体积由大到小的顺序是(填序号,下同)______ ______; 密度由大到小的顺序是__________。
(3) 22.2 g CaR2含R-0.4 mol,则CaR2的摩尔质量为___________,R的相对原子质量为___________。
(4) 将质量比为14 :15的N2和NO混合,则混合气体中N2和NO的物质的量之比为_________,氮原子和氧原子的个数比为___________,该混合气体的平均摩尔质量为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是常用于混合物的分离和提纯的装置示意图,请回答:

甲 乙 丙 丁
(1)图中仪器A、B、C的名称依次是 、 、 。
某研究性学习小组设计并进行以下实验从海带中提取碘:

(2)灼烧海带时,除需要泥三角、三脚架、坩埚外,还需要用到的实验仪器是__________(填字母)。
A.烧杯 B.蒸发皿 C.酒精灯 D.坩埚钳
(3)步骤③的操作名称是________,也可以用汽油做实验,理由是__________________。
(4)步骤④的目的是从含碘的苯溶液中分离出单质碘,同时回收苯,选择上述装置图_______________(填图的序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com