
分析 (1)高锰酸钾的化学式是KMnO4,溶于水完全电离得到K+和MnO4-,是强电解质;
(2)高锰酸钾固体溶于水后呈现紫红色;
(3)高锰酸钾固体受热分解可得到氧气、锰酸钾、二氧化锰;
(4)高锰酸钾溶液具有很强的氧化性,可以杀菌消毒.
解答 解:(1)高锰酸钾的化学式是KMnO4,溶于水完全电离得到K+和MnO4-,电离方程式为KMnO4=K++MnO4-,是强电解质,
故答案为:KMnO4;KMnO4=K++MnO4-;强电解质;
(2)高锰酸钾固体溶于水电离得到K+和MnO4-,溶液逐渐变为紫红色,
故答案为:溶液逐渐变为紫红色;
(3)高锰酸钾固体受热分解可得到氧气、锰酸钾、二氧化锰化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,
故答案为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(4)高锰酸钾溶液具有很强的氧化性,可以杀菌消毒,如医疗上可用稀高锰酸钾溶液来给伤口消毒,
故答案为:氧化性.
点评 本题考查了元素和化合物的性质,为高频考点,把握物质的性质是解题关键,注意基础知识的积累,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
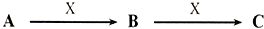
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁矿石在高温下被氧化成铁 | B. | 生铁中杂质被氧化 | ||
| C. | 铁矿石在高温下被焦炭还原成铁 | D. | 铁矿石在高温下被CO还原成铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸钠和金刚石 | B. | 晶体硅和水晶(SiO2) | ||
| C. | 水晶(SiO2)和干冰 | D. | NaCl和 I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
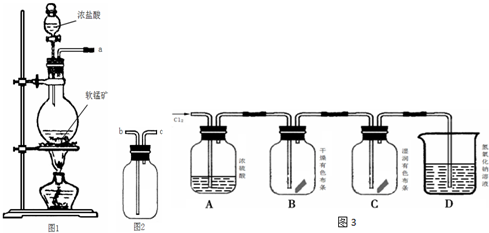
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过品红溶液 | |
| B. | 先通过氢氧化钠溶液,再通过澄清石灰水 | |
| C. | 先通过饱和碳酸氢钠溶液,再通过澄清石灰水 | |
| D. | 先通过酸性高锰酸钾溶液,再通过澄清石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
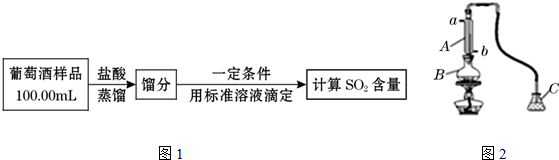
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Zn跟ICl的反应中,ZnI2既是氧化产物又是还原产物 | |
| B. | 在Zn跟ICl的反应中,ZnCl2既不是氧化产物又不是还原产物 | |
| C. | 在H2O跟ICl的反应中,ICl 既是氧化剂又是还原剂 | |
| D. | 在H2O跟ICl的反应中,ICl是氧化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com