
【题目】常温下,向20.00mL 0.1000molL﹣1 (NH4)2SO4溶液中逐滴加入0.2000molL﹣1 NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( ) 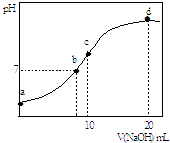
A.点a所示溶液中:c(SO42﹣)>c(NH4+)>c(H+)>c(OH﹣)
B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH﹣)
C.点d所示溶液中:c(SO42﹣)>c(NH3H2O )>c(OH﹣)>c(NH4+)
D.点c所示溶液中:c(SO42﹣)+c(H+)=c(NH3H2O )+c(OH﹣)
【答案】D
【解析】解:A.a点溶液中,铵根离子水解导致溶液呈酸性,即c(H+)>c(OH﹣),铵根离子水解程度较小,结合物料守恒知c(NH4+)>c(SO42﹣),所以溶液中离子浓度大小顺序是c(NH4+)>c(SO42﹣)>c(H+)>c(OH﹣),故A错误;
B.b点溶液中,溶液呈中性,则c(H+)=c(OH﹣),根据电荷守恒得c(H+)+c(NH4+)+c(Na+)=2c(SO42﹣)+c(OH﹣),硫酸铵的酸性较弱,要使混合溶液呈中性,则加入少量氢氧化钠即可,所以c(NH4+)>c(Na+),故B错误;
C.d点溶液中,二者恰好反应生成硫酸钠、一水合氨,且硫酸钠是氨水浓度的一半,一水合氨电离程度较小,所以c(NH3H2O )>c(SO42﹣),故C错误;
D.c点溶液中,溶液呈碱性,所以c(H+)<c(OH﹣),溶液中的溶质是等物质的量浓度的硫酸铵、硫酸钠、一水合氨,根据电荷守恒得c(H+)+c(NH4+)+c(Na+)=2c(SO42﹣)+c(OH﹣),根据物料守恒得,根据物料守恒得c(NH4+)+c(NH3H2O)=2c(SO42﹣)=2c(Na+),所以得c(SO42﹣)+c(H+)=c(NH3H2O )+c(OH﹣),故D正确;
故选D.
A.a点溶液中,铵根离子水解导致溶液呈酸性,但铵根离子水解较微弱;
B.b点溶液中,溶液呈中性,则c(H+)=c(OH﹣),根据溶质的性质判断;
C.d点溶液中,二者恰好反应生成硫酸钠、一水合氨,且硫酸钠是氨水浓度的一半;
D.c点溶液中存在电荷守恒和物料守恒,根据电荷守恒、物料守恒判断.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( ) 
A.该反应的△H=+91 kJmol﹣1
B.加入催化剂,该反应的△H变小
C.反应物的总能量小于生成物的总能量
D.如果该反应生成液态CH3OH,则△H减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下Ksp(AgCl)=1.6×10﹣10、Ksp(AgI)=2.0×10﹣16 , 下列说法中正确的是( )
A.含有大量Cl﹣的溶液中肯定不存在Ag+
B.AgI悬浊液中加入少量KI粉末,平衡AgI(s)?Ag+(aq)+I﹣(aq)向左移动,溶液中离子的总浓度会减小
C.AgCl悬浊液中逐渐加入KI固体至c(I﹣)= ![]() mol?L﹣1时,AgCl开始向AgI沉淀转化
mol?L﹣1时,AgCl开始向AgI沉淀转化
D.向浓度均为0.01 mol?L﹣1的KCl和KI的混合溶液中滴加AgNO3溶液,当Cl﹣开始沉淀时,溶液中I﹣的浓度为1.25×10﹣8 mol?L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是()
A. 氧化铜与稀硝酸反应:CuO + 2H+ ![]() Cu2+ + H2O
Cu2+ + H2O
B. 稀 H2SO4与铁粉反应:2Fe + 6H+ ![]() 2Fe3+ + 3H2↑
2Fe3+ + 3H2↑
C. 盐酸滴在石灰石上:2H++ CO32— ![]() H2O +CO2↑
H2O +CO2↑
D. 硫酸氢钠与过量氢氧化钡反应:Ba2++2OH—+ 2H+ +SO42—![]() BaSO4↓+ 2H2O
BaSO4↓+ 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中有HCHO、H2、O2 混合气体共20g和足量的Na2O2,用电火花引燃,使其完全反应,Na2O2增重8g,则原混合气体中O2的质量分数是()
A. 40% B. 33% C. 60% D. 36%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含碳的化合物能形成上千万种化合物,并且有的物质之间很容易发生转化.请回答下列问题:
(1)有机物M在有光的时候很容易转化成N,其过程如图: 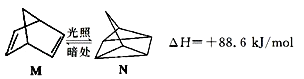
其中较稳定的物质是M,原因是 .
(2)已知 ![]() (l)的燃烧热为3267.5kJmol﹣1 ,
(l)的燃烧热为3267.5kJmol﹣1 , ![]() (l)+6O2(g)═6CO2(g)+3H2(g)
(l)+6O2(g)═6CO2(g)+3H2(g)
△H=a kJmol﹣1 , 则a﹣3267.5(填“>”、“<”或“=”).
(3)使Br2(g)和H2O(g)在1500℃时与焦炭反应,生成HBr和CO2 , 当有1mol Br2(g)参与反应时释放出125kJ热量,写出该反应的热化学方程式 .
(4)将C(石墨)、Al粉和TiO2固体在一定比例的条件下,在极高的温度下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)△H=﹣1440kJmol﹣1 , 则反应过程中,每转移amol电子放出的热量为(用含a的表达式表示).
(5)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=+490.0kJmol﹣1
CO(g)+ ![]() O2(g)=CO2(g)△H=﹣280.0kJmol﹣1
O2(g)=CO2(g)△H=﹣280.0kJmol﹣1
C(石墨)+O2(g)=CO2(g)△H=﹣390.5kJmol﹣1
2Fe2O3(s)=4Fe(s)+3O2(g)△H= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某盐酸的浓度,用0.2molL﹣1的碳酸钠标准液与该酸进行反应,为了准备480mL的标准液,某同学进行了下列操作(已乱序)
(1)①摇匀后,继续加蒸馏水至刻度线1cm处,改用胶头滴管加水至 止,然后盖上瓶塞,并振荡后倒入指定的试剂瓶内.
②向烧杯中注入约100mL水,在搅拌下很快溶解完.
③用自来水洗涤了烧杯3次,将洗涤液注入了废液缸内.
④将回温后的溶液沿玻璃棒注入 中. ⑤用天平称量 克碳酸钠粉末倒入了250mL的烧杯中.
(2)该同学操作正确的顺序是 (填编号)
(3)该同学的操作中步操作是错的(填编号),导致所配溶液的浓度 0.2molL﹣1 , (填=、>、<).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中有下列四组试剂,某同学欲分离含有氯化钾、氯化铁和硫酸钡的混合物,应选用的试剂组合是( )
A. 水、硝酸银溶液、稀硝酸 B. 水、氢氧化钾溶液、硫酸
C. 水、氢氧化钠溶液、稀盐酸 D. 水、氢氧化钾溶液、盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com