
| A. |  Mg作负极,电子流向:Mg一→稀硫酸一→A1 | |
| B. |  Al作负极,电极反应式6H2O+6e-═6OH-+3H2↑ | |
| C. |  Cu作负极,电极反应式Cu-2e-═Cu2+ | |
| D. |  Cu作正极,电极反应式:2H++2e═H2↑ |
分析 A、根据在硫酸中金属镁比铝活泼是负极,电子不经过溶液;
B、根据在氢氧化钠中金属铝比镁活泼是负极,发生失电子氧化反应;
C、金属铁在常温下遇浓硝酸钝化,所以所以负极为铜,发生失电子氧化反应;
D、铁、铜、氯化钠构成的原电池中,金属铁发生的是吸氧腐蚀.
解答 解:A、在硫酸中金属镁比铝活泼,失电子的是金属镁,为负极,但电子不经过溶液,故A错误;
B、在氢氧化钠中金属铝比镁活泼,失电子的是金属铝,为负极,电极反应式为Al+4OH--3e-═AlO2-+2H2O,故B错误;
C、金属铁在常温下遇浓硝酸钝化,所以负极为铜,电极反应式Cu-2e-═Cu2+,故C正确;
D、铁、铜、氯化钠构成的原电池中,金属铁为负极,金属铜为正极,铁发生的是吸氧腐蚀,正极上是氧气得电子的过程,故D错误.
故选C.
点评 本题考查学生原电池的工作原理知识,可以根据所学内容来回答,难度不大.


 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:选择题
| A. | 一定温度下的可逆反应,只有达到平衡时才具有平衡常数 | |
| B. | 化学平衡移动时,平衡常数一定改变 | |
| C. | 对于一个确定的反应来说,平衡常数的数值越大,反应限度越大 | |
| D. | 化学平衡常数大的可逆反应,所有反应物的转化率一定大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 太阳能热水器、反射式太阳灶 | |
| B. | 太阳能电池 | |
| C. | 利用生活垃圾中生物质能焚烧发电 | |
| D. | 通过植物的光合作用,产生生物质能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
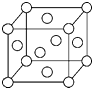 A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大.A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1 817kJ/mol,I3=2 745kJ/mol,I4=11 575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34.请回答下列问题:
A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大.A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1 817kJ/mol,I3=2 745kJ/mol,I4=11 575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
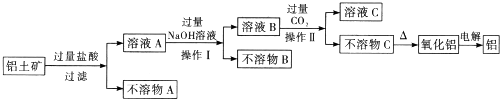

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的稀硫酸中含有的H+数为0.1NA | |
| B. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA | |
| C. | 50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA | |
| D. | 80g NH4NO3晶体中含有NH4+小于个NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | 原子结构特征或有关物质的性质 |
| A | 原子的最外层电子数是其内层电子数的2倍 |
| B | 其单质是空气中含量最多的物质 |
| C | 原子的最外层电子数是其电子层数的4倍 |
| D | 位于第ⅡA族,其原子半径比E的大 |
| E | 是金属元素,其氧化物和氢氧化物都有两性,且与D在同一周期 |
| F | 原子序数16,其单质在通常状况下为固体 |
| G | 原子的最外层电子数比其次外层电子数少1个 |
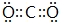 .
. NH4++OH-(用方程式表示)
NH4++OH-(用方程式表示)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6g | B. | (a-1.6)g | C. | (a-3.2)g | D. | 无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com