
| A. | 分子中三个碳原子可能处在同一直线上 | |
| B. | 它的五氯代物数目与三氯代物的数目相等 | |
| C. | 它属于烃类 | |
| D. | 该物质易溶于水,难溶于有机物 |
分析 A.根据烷烃分子的空间结构判断;
B.依据等效氯判断即可;
C.只有C、H两种元素组成的有机物属于烃;
D.有机物一般难溶于水,易溶于有机物.
解答 解:A.丙烷碳链为V型,三个碳原子不在同一直线上,全氟丙烷可以看成丙烷分子中所有氢原子被氟原子取代,所以分子中三个碳原子不在同一直线上,故A错误;
B.C3F8的五氯代物是5个F原子被5个Cl原子取代;三氯代物相当于C3Cl8中的5个Cl原子被5个F原子取代,所以五氯代物种数和三氯代物一样多,故B正确;
C.只有C、H两种元素组成的有机物属于烃,此有机物中不含H,且含有F原子,故C错误;
D.该物质难溶于水,易溶于有机物,故D错误.
故选B.
点评 本题考查的知识点较多,侧重考查学生对各知识点的掌握程度,利用迁移思想是解A选项的关键.


科目:高中化学 来源: 题型:多选题
| A. | 电池的总反应式:Cd+2NiOOH+2H2O$?_{充电}^{放电}$2Ni(OH)2+Cd(OH)2 | |
| B. | 电池充电时,镉元素被还原 | |
| C. | 电池放电时,电池负极周围溶液的pH不断增大 | |
| D. | 电池充电时,电池的负极和电源的正极连接 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电离的c(H+):①=②=③=④ | |
| B. | 将②、③溶液混合后,pH=7,消耗溶液的体积:②<③ | |
| C. | 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量,②最大 | |
| D. | 向溶液中加入100 mL水后,溶液的pH:③>④>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用沸点数据可以推测将一些液体混合物分离开来的可能性 | |
| B. | 通过比较溶度积常数(Ksp)与溶液中有关离子浓度幂的乘积--离子积(Qc)的相对大小,可以判断难溶电解质在给定条件下能否生成或溶解 | |
| C. | 利用溶液的pH与7的大小关系,可以判断任何温度下溶液的酸碱性 | |
| D. | 根据分散质粒子直径的大小,可以判断分散系的类别 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
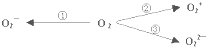 据2004年1月17日网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,是一种高能量分子.
据2004年1月17日网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,是一种高能量分子.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
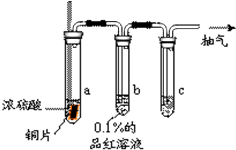 某实验小组同学为了探究铜与浓硫酸的反应,对教材中的装置进行简单改进,在大试管a中加了一根长玻璃导管(如图,图中夹持仪器和加热仪器没有画出).
某实验小组同学为了探究铜与浓硫酸的反应,对教材中的装置进行简单改进,在大试管a中加了一根长玻璃导管(如图,图中夹持仪器和加热仪器没有画出).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 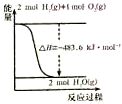 由图可知:H2的燃烧热为241.8kJ•mol-1 | |
| B. | 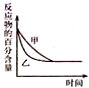 图中表示压强对反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙曲线对应的压强比甲的压强大 | |
| C. | 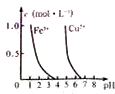 如图,若除去CuSO4溶液中的Fe2+,可向溶液中加入适量CuO,调节pH=4,过滤 | |
| D. | 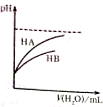 如图表示常温下HA、HB两种酸加水稀释时溶液pH的变化,则相同条件下,NaA溶液的pH大于NaB溶液的pH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com