
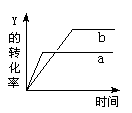
反应 X(气)+ Y(气) 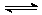 2Z(气)+ Q(Q>0),在一定条件下,反应物Y的转化率与反应时间(t)的关系如右图所示。若使曲线a变为曲线b可采取的措施是( )
2Z(气)+ Q(Q>0),在一定条件下,反应物Y的转化率与反应时间(t)的关系如右图所示。若使曲线a变为曲线b可采取的措施是( )
A.加入催化剂 B.降低温度
C.增大压强 D.增大Y的浓度
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
在一密闭容器中有CO、H2、O2共16.5g和足量的Na2O2,用电火花引燃,使其完全反应,Na2O2增重7.5g,则原混合气体中O2的质量分数是
A. 54.5% B.40% C.36% D.33.3%
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生用下图所示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气。回答下列问题:
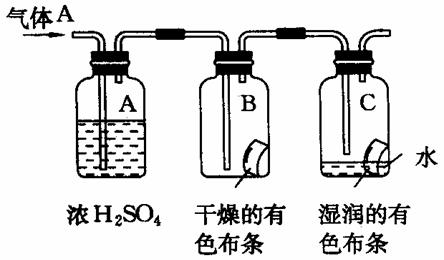
该项研究(实验)的主要目的是
(2)浓H2SO4的作用是 。
与研究目的直接相关的实验现象是
(3)从物质性质的方面来看,这样的实验设计还存在安全隐患,表
现是 。克服安全隐患的措施是(用化学方程式表示):
。
(4)若将剩余的氯气收集,测其在标准状况下的体积为11.2升,
让其与氢气充分化合,该反应的方程式为 ;
将生成的气体溶于水,配成500ml溶液,则该溶液中溶质的物质
的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知热化学方程式: ①H2(g)+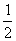 O2(g)==H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)==H2O(g) ΔH=-241.8 kJ·mol-1
②2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1
③H2(g)+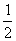 O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
④2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1则氢气的燃烧热为( )
A.241.8 kJ/mol B.483.6 kJ/mol
C.285.8 kJ/mol D.571.6 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol ·L-1)随反应时间(min)的变化情况如下表所示。
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol ·L-1)随反应时间(min)的变化情况如下表所示。
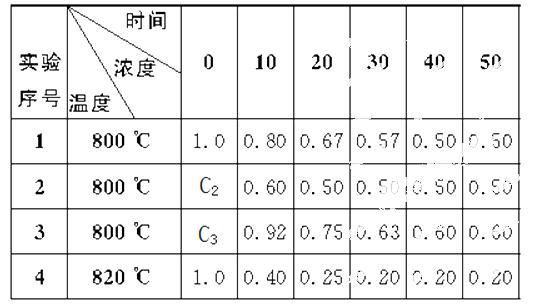
根据上述数据,完成下列填空:
(1)在实验1中,反应在10—20 min时间内平均反应速率为________mol ·L-1·min-1。
(2)在实验2中,A的初始浓度c2=________mol ·L-1,反应经20 min就达到平衡,可推测实验2中还隐含的条件是_______________________ _____。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3____v1(填“>”“=”或“<”),且c3____1.0 mol ·L-1(填“>”“=”或“<”)。
(4)在实验4中,反应在20—30 min时间内平均反应速率为________。
比较实验4和实验1,可推测该反应是_______(填“吸热”或“放热”)反应,结合表中数据说明原因______ _ _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学反应速率的说法正确的是( )
A.化学反应速率是指一定时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加
B.化学反应速率为0.8 mol·(L·s)-1是指1 s时某物质的浓度为0.8 mol·L-1
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越大,反应现象就越明显
查看答案和解析>>
科目:高中化学 来源: 题型:
淀粉溶液是一种胶体,并且淀粉遇到碘单质会出现明显的蓝色特征。现将淀粉和稀Na2SO4溶液混合,装在半透膜中,浸泡在盛蒸馏水的烧杯内,过一段时间后,取烧杯中液体进行实验,能证明半透膜完好无损的是
A.加入BaCl2溶液产生白色沉淀 B.加入碘水不变蓝
C.加入BaCl2溶液产生没有白色沉淀产生 D.加入碘水变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.化学反应过程都伴随着能量变化
B.放热反应的发生无需任何条件
C.H2SO4和NaOH的反应是吸热反应
D.化学键的断裂和形成与反应放热和吸热无关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com