
 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol-1表示.请认真观察下图,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol-1表示.请认真观察下图,然后回答问题.分析 (1)从图上分析,反应物能量高于生成物,反应放热;反应物断键要吸收能量;反应热等于生成物与反应物的能量差;
(2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,逆反应的活化能=正反应的活化能+反应的焓变;
(3)图象分析虚线是降低反应的活化能,化学平衡不变化,单位体积内活化分子数增多反应速率加快,改变的条件是加入了催化剂.
解答 解:(1)图示反应是放热反应,反应物断键要吸收能量,所以该反应需要环境先提供能量,反应热等于生成物与反应物的能量差,即E1-E2,故答案为:放热;需要;E2-E1;
(2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,逆反应的活化能=正反应的活化能+反应的焓变;H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1,该反应的活化能为167.2kJ•mol-1,则其逆反应的活化能=167.2KJ/mol+241.8KJ/mol=409.0KJ/mol,
故答案为:409.0KJ/mol;
(3)图象分析可知,虚线表示的是降低反应的活化能,单位体积内活化分子数增多反应速率加快,但达到平衡状态相同,化学平衡不变化,改变的条件是加入了催化剂;故答案为:减小;增大;增大;使用催化剂.
点评 本题考查了化学反应能量变化分析,活化能概念的理解应用,化学平衡影响因素的分析判断,掌握基础是关键,题目难度不大.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L H2O含有的分子数大于NA | |
| B. | 通常状况下,NA个CO2分子占有的体积为44.8 L | |
| C. | 通常状况下,22.4L O3中所含的氧原子数为3NA | |
| D. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.01 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO42-、NO3- | B. | NO3-、Cl- | C. | SO32-、NO3- | D. | Cl-、NO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
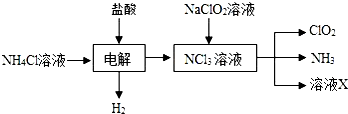

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电离平衡逆向移动 | B. | c(OH-)增大 | ||
| C. | 电离平衡常数增大 | D. | n(OH-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com