
下面是关于中和滴定的实验叙述:取25.00 mL未知浓度的HCl溶液。在横线标明操作中,有错误的是
a.放入锥形瓶中,此瓶需事先用蒸馏水洗净。 b.并将该瓶用待测液润洗过。
c.加入几滴酚酞作指示剂。 d.取一支酸式滴定管,经蒸馏水洗净。
e.直接往其中注入标准NaOH溶液,进行滴定。
f.一旦发现溶液由无色变成粉红色,即停止滴定,记下数据。
A.d、e、f B.b、d、e、f C.b、d、e D.b、c、e、f
科目:高中化学 来源:2013-2014四川省成都市高第二期期末高一化学试卷(解析版) 题型:选择题
下列离子方程式或化学方程式书写正确的是 ( )
A.实验室用氯化铵与消石灰制氨气 NH4++OH- NH3↑+H2O
NH3↑+H2O
B.将CO2通入BaCl2溶液中 H2O +CO2+Ba2+ =BaCO3↓+2H+
C.少量SO2通入加漂白粉的水溶液中 SO2+H2O+Ca2++3ClO- = CaSO4↓+2HClO+Cl-
D.用H2还原MgO H2+MgO  Mg+H2O
Mg+H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省成都市五校高一下学期期中联考化学试卷(解析版) 题型:选择题
下列电子式书写正确的是 ( )
A.氮气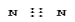 B.二氧化碳
B.二氧化碳
C.水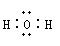 D.氯化铵
D.氯化铵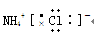
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省宜昌市春季期中考试高二化学试卷(解析版) 题型:选择题
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
A.两种分子的中心原子的杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强
D.氨气分子是极性分子而甲烷是非极性分子
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省宜昌市春季期中考试高二化学试卷(解析版) 题型:选择题
下列各选项中所述的两个量,前者一定大于后者的是
A.1 L 0.3 mol·L-1 CH3COOH溶液和3 L 0.1 mol·L-1 CH3COOH溶液中的H+数
B.纯水在25℃和80℃时的pH
C.在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数
D.相同条件下,H2分别与Cl2、F2反应的反应速率
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省宜昌市春季期中考试高二化学试卷(解析版) 题型:选择题
下列过程或现象与盐类水解无关的是
A.纯碱溶液去油污 B.稀醋酸溶液加热时其pH 减小
C.小苏打溶液与AlCl3溶液混合产生气体和沉淀 D.浓的硫化钠溶液有臭味
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省高三5月冲刺卷理综化学试卷(解析版) 题型:选择题
已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,A在反应中既不容易得电子也不容易失电子,元素B的最外层电子数是电子层数的3倍,元素D与A为同族元素,元素C和E形成的化合物CE是海水中的主要成分。下列说法不正确的是
A.离子半径:r(E)>r(B)>r(C)
B.熔点:CE>DE4
C.C与B形成的两种化合物中化学键类型不同
D.A、D、E的最高价氧化物对应水化物的酸性逐渐增强
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省长春市高二下学期期末考试化学试卷(解析版) 题型:选择题
下列反应中,氧化剂与还原剂物质的量的关系为1:2的是
A.4KI+O2+2H2O=4KOH+2I2
B.2CH3COOH+Ca(ClO)2=2HClO+(CH3COO)2 Ca
C.I2+2NaClO3=2NaIO3+Cl2
D.MnO2+4HCl MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高二上学期期末考试化学(B卷)试卷(解析版) 题型:填空题
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇:
( CO2 + 3H2 = CH3OH + H2O ),并开发出直接以甲醇为燃料的燃料电池。
已知 H2(g)、 CO(g) 和 CH3OH(l) 的燃烧热△H分别为?285.8 kJ·mol?1、?283.0 kJ·mol?1和?726.5kJ·mol?1。请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_____________kJ
(2)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如图所示(注:T1、T2均大于300℃);下列说法正确的是________(填序号)
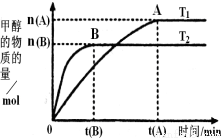
①温度为T1时,从反应开始到平衡,生成甲醇的
平均速率为v(CH3OH)= 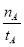 mol·L?1·min?1
mol·L?1·min?1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时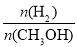 增大
增大
(3)在T1温度时,将1molCO2和3molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为?,则容器内的压强与起始压强之比为 ( 用 ? 表示 )
(4)已知甲醇燃烧的化学方程式为2CH3OH +3O2 =2CO2 +4H2O ,在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为 ,正极的反应式为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com