
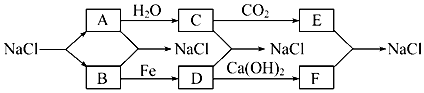
分析 由2NaCl(熔融)$\frac{\underline{\;通电\;}}{\;}$2Na+Cl2,且A与B反应生成NaCl,B与Fe反应生成D,可知A为Na,B为Cl2,结合图中转化可知C为NaOH,E为Na2CO3,D为FeCl3,FeCl3与氢氧化钙反应生成F为CaCl2,E与F反应生成碳酸钙和NaCl,以此来解答.
解答 解:(1)由上述分子可知,A、B、C、D、E、F分别为Na、Cl2、NaOH、FeCl3、Na2CO3、CaCl2,
故答案为:Na;Cl2;NaOH;FeCl3;Na2CO3; CaCl2;
(2)①A→C的反应为2Na+2H2O=2 NaOH+H2↑,②B→D的反应为2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$ 2FeCl3,
故答案为:2Na+2H2O=2 NaOH+H2↑;2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$ 2FeCl3;
(3)过氧化钠与二氧化碳反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(4)工业上制取漂白粉的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
点评 本题考查无机物的推断,为高频考点,把握图中转化、电解原理、元素化合物知识为解答本题关键,侧重分析与推断能力的考查,注意化学用语的使用,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 书写共价化合物的电子式只需把结构式中的一个单键改成一对电子即可 | |
| B. | 已知  ,可见,成键的一方不提供电子也可能形成化学键 ,可见,成键的一方不提供电子也可能形成化学键 | |
| C. | 将某种化合物溶于水,若能导电说明这种化合物是离子化合物 | |
| D. | 只要是离子化合物其熔点就比共价化合物的熔点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | 放热1940kJ | B. | 吸热1940kJ | C. | 放热485kJ | D. | 吸热485kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Cl2+2KBr═Br2+2KCl | B. | 2NaHCO3$\frac{\underline{\;△\;}}{\;}$Na2CO3+H2O+CO2↑ | ||
| C. | 3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2 | D. | 2Na2O2+2CO2═2Na2CO3+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com