
(10分)
(1)元素最高正化合价为+6,其负化合价为____,某元素R与氢形成的气态氢化物的化学式为RH3,其最高价氧化物的化学式为___________
(2)下列各题中有关物质的比较,请用“>”、“<”、“=”填空
酸性: H3PO4 HNO3 ,H2SO4 HClO4
热稳定性:CH4 NH3 ,HCl HI
(3)1-18号元素中,最外层电子数是次外层电子数二倍的元素是 ,原子结构示意图 ,能与氧形成的氧化物的化学式 、 。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:物理教研室 题型:022
(1)氯气能从碘化钾中将碘置换出来。据此判断氯元素和碘元素非金属性的强弱。
(2)磷元素和硫元素的最高正化合价分别为+5、+6,且磷元素的非金属性弱于硫元素。请写出这两种元素最高正化合价氧化物对应水化物的化学式,并比较它们酸性的强弱。
(3)H2SO4、H2SeO4分别是硫元素和硒元素最高正化合价氧化物对应的水化物,且H2SO4的酸性强于H2SO4。据此判断硫元素和硒元素氧化能力的强弱。
(4)溴单质在加热的条件下可与氢气化合生成HBr,碘单质在高温条件才能与氢气化合生成HI。据此判断HBr和HI稳定性的强弱。
(5)请用一个化学反应事实说明氟的非金属性强于氧,并写出相关的化学反应方程式。
(6)能够说明氯元素的非金属性强于溴元素的化学事实有哪些?
查看答案和解析>>
科目:高中化学 来源: 题型:022
按照下列要求,回答有关问题。
(1)氯气能从碘化钾中将碘置换出来。据此判断氯元素和碘元素非金属性的强弱。
(2)磷元素和硫元素的最高正化合价分别为+5、+6,且磷元素的非金属性弱于硫元素。请写出这两种元素最高正化合价氧化物对应水化物的化学式,并比较它们酸性的强弱。
(3)H2SO4、H2SeO4分别是硫元素和硒元素最高正化合价氧化物对应的水化物,且H2SO4的酸性强于H2SO4。据此判断硫元素和硒元素氧化能力的强弱。
(4)溴单质在加热的条件下可与氢气化合生成HBr,碘单质在高温条件才能与氢气化合生成HI。据此判断HBr和HI稳定性的强弱。
(5)请用一个化学反应事实说明氟的非金属性强于氧,并写出相关的化学反应方程式。
(6)能够说明氯元素的非金属性强于溴元素的化学事实有哪些?
查看答案和解析>>
科目:高中化学 来源: 题型:
(一)短周期A、B、C、D 四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,可生成一种原子个数比为1:1的且不溶于水的固体E;D的L层电子数等于K、M两个电子层上电子数之和。
(1)A元素的名称为 (2)B原子的阴离子的结构示意图为 。
(3)C元素位于元素周期表中第 周期、第 族。
(4) D的质子数和中子数相等,它的最高价氧化物对应的水化物化学式为: 。
(二)根据元素周期表及其元素周期律回答下列问题:
(1)预测52号元素在周期表中的位置:第 周期 族。
(2)已知硒为第四周期第ⅥA族元素,据此推测硒不可能具有的性质是( )
A.最高正化合价为+6价, B.气态氢化物比H2S稳定,
C.最高价氧化物的水化物的酸性比硫酸弱, D.单质在常温下可与氢气化合。
(3)已知X为ⅡA族元素,其原子序数为a,Y与X位于同一周期,且为ⅢA族元素,则Y的原子序数b= (写出b与a所有可能的关系)。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省杭州地区七校高一下学期期中联考理科化学试卷(解析版) 题型:填空题
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
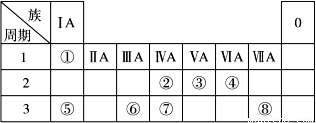
(1)地壳中含量居于第二位的元素在周期表中的位置是________________。
(2)②的最高价氧化物固态时的晶体类型:______________;⑦的最高价氧化物固态时的晶体类型:______________。
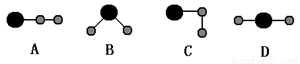
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式______________,______________。若用球棍模型表示①和④形成的化合物的分子结构,应该是_____________。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是( )
A.最高正化合价为+6价, B.气态氢化物比H2S稳定,
C.最高价氧化物的水化物的酸性比硫酸弱, D.单质在常温下可与氢气化合。
(5) 已知X为ⅡA族元素(第一到第七周期),其原子序数为a,Y与X位于同一周期,且为ⅢA族元素,则Y的原子序数b与a所有可能的关系式___________________________。
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
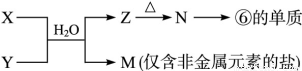
X溶液与Y溶液反应的离子方程式________, M中阳离子的鉴定方法____________。
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com