
| A. | r(Na)>r(Mg)>r(Al)>r(K) | B. | r(K+)>r(Ca2+)>r(S2-)>r(Cl-) | ||
| C. | r(Na)>r(K)>r(Ca)>r(Mg) | D. | r(F-)>r(Na+)>r(Mg2+)>r(Al3+) |
分析 比较粒子半径可以从以下角度分析:(1)元素周期表中同主族元素随原子序数的增加,电子层数增加,原子半径增大;同周期元素随原子序数的增加,原子半径依次减小.(2)当原子核外电子排布相同时,原子核内质子数越多,对核外电子的吸引越强,粒子半径越小.(3)同主族元素带等量电荷的离子,核电荷数越大,半径越大.
解答 解:A.同主族自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:r(K)>r(Na)>r(Mg)>r(Al),故A错误;
B.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:r(S2-)>r(Cl-)>r(K+)>r(Ca2+),故B错误;
C.同主族自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:r(K)>r(Ca)>r(Mg),r(K)>r(Na)>r(Mg),故C错误;
D.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:r(F-)>r(Na+)>r(Mg2+)>r(Al3+),故D正确.
故选:D.
点评 本题考查微粒半径比较,难度不大,掌握微粒半径比较规律,理解影响微粒半径的因素.


科目:高中化学 来源: 题型:选择题
| A. | 晶体中不存在独立的“分子” | |
| B. | 含有1 mol C的金刚石中,形成的共价键有2 mol | |
| C. | 是自然界中硬度最大的物质 | |
| D. | 化学性质稳定,即使在高温下也不会与氧气发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用浓硝酸做试剂比较铁和铜的金属活动性 | |
| B. | 使用干燥洁净玻璃棒将氯水滴在干燥pH试纸上,测定氯水的pH | |
| C. | 欲检验Br-的存在,可在溶液中先加入氯水、再加入CCl4,振荡、静置,观察下层溶液显橙红色 | |
| D. | 氢氧化铁胶体在直流电场中,一段时间阴极附近红褐色加深,说明胶体带正电荷 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值,下列叙述正确的是
A.44g CO2含有氧原子数为NA
B.物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-离子数为NA
C.标准状况下,22.4L四氯化碳含有的分子数为NA
D.常温常压下,14g N2含有分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)机动车尾气和燃烧产生的烟气含氮的氧化物,可以用CH4催化还原NOx消除氮氧化物的污染.
(1)机动车尾气和燃烧产生的烟气含氮的氧化物,可以用CH4催化还原NOx消除氮氧化物的污染.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
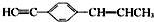 的说法正确的是( )
的说法正确的是( )| A. | 所有碳原子有可能都在同一个平面上 | |
| B. | 最多可能有9个碳原子在同一平面上 | |
| C. | 只能有4个碳原子在同一直线上 | |
| D. | 有7个碳原子可能在同一条直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
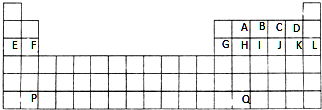
| A. | 若T的最低化合价为-3,则J的最高正化合价为+6 | |
| B. | 若HnJOm为强酸,则G是位于ⅤA以后的活泼非金属元素 | |
| C. | 若M(OH)n+1为强碱,则R(OH)n也为强碱 | |
| D. | 若M的最高正化合价为+4,则五种元素都是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 A>B>C | B. | 气态氢化物的稳定性HA>H2B>H3C | ||
| C. | 阴离子还原性C3->B2->A- | D. | 非金属性A>B>C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com