
| A、H2O>H2Te>H2Se>H2S |
| B、He>Ne>Ar>Kr |
| C、I2>Br2>Cl2>F2 |
| D、GeH4>SiH4>CH4 |


科目:高中化学 来源: 题型:
| A、卤化氢的沸点由高到低的顺序:HI、HBr、HCl、HF |
| B、碱性由强到弱顺序:LiOH、NaOH、KOH、CsOH |
| C、Cl2能氧化Br-,Br2能氧化I-、I2能氧化SO32-,则还原性由强到弱的顺序:Cl2、Br2、I2 |
| D、原子半径由大到小顺序:Cs、K、Na、Li |
查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,取pH=2的HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )
常温下,取pH=2的HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )| A、HB的电离方程式为HB═H++B- |
| B、稀释前,c(HB)>c(HA)=0.01mol?L-1 |
| C、NaA的水溶液中,离子浓度大小为c(Na+)>c(A-)>c(OH-)>c(H+) |
| D、NaA、NaB的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同温同压下,相同体积的物质,其物质的量一定相等 |
| B、1升一氧化碳气体一定比1升氯气的质量小 |
| C、任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等 |
| D、等体积、等物质的量浓度的强碱中所含的氢氧根离子数一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用托盘天平称量20gNaOH时,使用生锈的砝码 |
| B、容量瓶中有少量的水 |
| C、定容时仰视容量瓶刻度线 |
| D、NaOH溶解后立即注入容量瓶中,洗涤、移液,并加蒸馏水定容至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a>b>c>d |
| B、a>c>d>b |
| C、c>a>b>d |
| D、b>d>c>a |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、D A B C |
| B、D C A B |
| C、B A D C |
| D、A B C D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇的结构简式:C2H6O |
| B、Cl-的电子排布式:1s22s22p63s23p6 |
C、硫离子的结构示意图: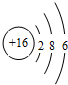 |
| D、氯化钠的分子式:NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气体密度不再发生变化 |
| B、A、B的物质的量浓度之比等于1:2 |
| C、容器内总压强不再改变 |
| D、单位时间内消耗n mol A,同时消耗2n mol B |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com