
| A. | 过滤操作中,玻璃棒与三层滤纸 | |
| B. | 过滤操作中,漏斗下端管口与烧杯内壁 | |
| C. | 分液操作中,分液漏斗下端管口与烧杯内壁 | |
| D. | 用胶头滴管向试管滴加液体时,滴管尖端与试管内壁 |
分析 A.三层滤纸一侧较厚,不易捣破;
B.过滤时,防止液滴飞溅;
C.分液时,防止液滴飞溅;
D.滴加液体时,防止试剂污染或损失.
解答 解:A.三层滤纸一侧较厚,不易捣破,则过滤操作中,玻璃棒紧靠三层滤纸,故A不选;
B.过滤时,防止液滴飞溅,则过滤操作中,漏斗下端管口紧靠烧杯内壁,故B不选;
C.分液时,防止液滴飞溅,则分液操作中,分液漏斗下端管口紧靠烧杯内壁,故C不选;
D.滴加液体时,防止试剂污染或损失,则用胶头滴管向试管滴加液体时,滴管尖端不能接触试管内壁,应悬空正放,故D选;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握实验基本操作、混合物分离提纯、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:实验题
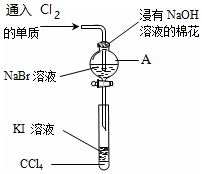 为了验证VIIA族部分元素非金属性递变规律,设计如图进行实验,
为了验证VIIA族部分元素非金属性递变规律,设计如图进行实验,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L乙醇中碳氢键的数目为0.5 NA | |
| B. | 1 L 0.1 mol•L-1硫酸钠溶液中含有的氧原子数为0.4 NA | |
| C. | 0.1 mol KI与0.1 mol FeCl3在溶液中反应转移的电子数为0.1 NA | |
| D. | 0.1 mol乙烯与乙醇的混合物完全燃烧所消耗的氧分子数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
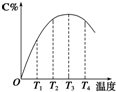 可逆反应A(g)+B(g)?2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示.
可逆反应A(g)+B(g)?2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 1760℃ | 2400℃ | 2730℃ |
| 平衡常数 | 2.4×10-4 | 6.4×10-3 | 8.9×10-3 |
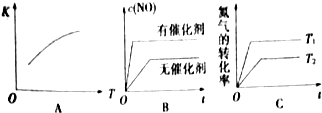
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4mol/L | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/10-3mol/L | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg、Al、Cu在空气中长时间放置,在其表面均生成氧化物 | |
| B. | 把SO2气体分别通入到BaCl2、Ba(NO3)2溶液中均有白色沉淀生成 | |
| C. | 工业上通常用电解钠、镁、铝对应的熔融氯化物制得该三种金属单质 | |
| D. | 将水蒸气通过灼热的铁粉,反应后固体质量增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| B. | 不慎将浓碱溶液沾到皮肤上,应立即用稀酸液冲洗 | |
| C. | 酒精灯着火时可用水扑灭 | |
| D. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
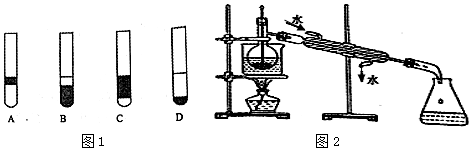
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com