

 +R3
+R3 $\stackrel{C_{2}H_{5}ONa}{��}$
$\stackrel{C_{2}H_{5}ONa}{��}$ +R2OH
+R2OH ��
�� ��
��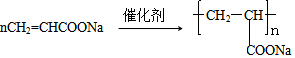 ��
�� ��
�� ���� ��B�Ľṹ��ʽ��֪AΪCH2=CHCOOCH2CH3�������Ƽ��֪HΪ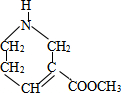 ���Ա�E��G�ķ���ʽ��֪EΪ
���Ա�E��G�ķ���ʽ��֪EΪ ����CΪ
����CΪ ��DΪ
��DΪ ����϶�Ӧ�л���Ľṹ�����ŵ����ʽ��1������6����
����϶�Ӧ�л���Ľṹ�����ŵ����ʽ��1������6����
��7���Ա�ϩ���Ҵ�Ϊ��ʼԭ�ϣ��ϳ�CH2=CHCOOCH2CH3��Ӧ������CH2=CHCOOH�����ɱ�ϩ����������ȡ����Ӧ����CH2=CHCH2OH��Ȼ��������ֱ�����CH2=CHCHO��CH2=CHCOOH�����Ҵ�����������Ӧ������CH2=CHCOOCH2CH3��
��� �⣺��1���ɽṹ��ʽ��֪B�к��������ŵ�����Ϊ�������ʴ�Ϊ��������
��2����Ӧ����A��C=C������C-C����Ϊ�ӳɷ�Ӧ����Ӧ��Ϊ������ȥ��Ӧ����Ӧ����ΪŨ���ᡢ���ȣ��ʴ�Ϊ���ӳɷ�Ӧ��Ũ���ᡢ���ȣ�
��3����Ӧ��Ϊ������Ӧ������ʽΪ ��
��
�ʴ�Ϊ�� ��
��
��4�������Ϸ�����֪CΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��5��a����Ӧ���м�ȡ��Hԭ�ӣ�Ϊȡ����Ӧ����a��ȷ��
b�����Ƽ��뻯����G���еĹ����Ų�ͬ�����߲���ͬϵ���b����
c��Dֻ������������������Һ��Ӧ����1mol D�������1mol NaOH������Ӧ����c����
�ʴ�Ϊ��a��
��6��AΪCH2=CHCOOCH2CH3��A��NaOH��Һ��ˮ������CH2=CHCOONa������̼̼˫�����ɷ����Ӿ۷�Ӧ������ʽΪ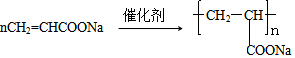 ��
��
�ʴ�Ϊ��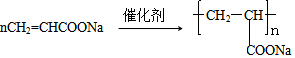 ��
��
��7���Ա�ϩ���Ҵ�Ϊ��ʼԭ�ϣ��ϳ�CH2=CHCOOCH2CH3��Ӧ������CH2=CHCOOH�����ɱ�ϩ����������ȡ����Ӧ����CH2=CHCH2OH��Ȼ��������ֱ�����CH2=CHCHO��CH2=CHCOOH�����Ҵ�����������Ӧ������CH2=CHCOOCH2CH3����Ӧ������Ϊ ��
��
�ʴ�Ϊ�� ��
��
���� ���⿼���л��ϳɣ�Ϊ�߿��������ͣ����ؿ���ѧ���ķ�����������Ŀ�Ѷ��еȣ��Ӻϳ�������ϳ����л�������ʿ��Խ������ʵ��ƶϣ��������ճ����л���ṹ������Ϊ���ؼ���


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ѹǿ���÷�Ӧ�����淴Ӧ���ʿ��ܲ��� | |
| B�� | �����¶ȣ�����Ӧ���ʱ��淴Ӧ���ʼ�С�ij̶�С | |
| C�� | ��������������������ƽ�������ƶ���ƽ�ⳣ��Kֵ���� | |
| D�� | ����������ʵ�������0.5 molʱ�ﵽƽ�⣬��������·�Ӧ�ų�0.5 Q KJ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | c��NH4+����c��NO3-����c��H+����c��OH-�� | B�� | c��NO3-����c��NH4+����c��H+����c��OH-�� | ||
| C�� | c��H+����c��NH4+����c��NO3-����c��OH-�� | D�� | c��OH-����c��NO3-����c��NH4+����c��H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ħ��������� | B�� | �����ܶ���� | C�� | ����������� | D�� | ������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| �� | X |
| Y | Z |
| ���ݱ�� | ����NaOH��Һ�����/mL | ��ҺpH | |
| HX | HZ | ||
| �� | 0 | 3 | 1 |
| �� | 20.00 | a | 7 |
| A�� | ������a��7 | |
| B�� | HX��HZ�������Ϻ�pH=1+lg2 | |
| C�� | Y��Z��Ԫ�صļ��⻯�����ȷֽ⣬ǰ�߷ֽ��¶ȸ� | |
| D�� | 0��l000 mol/L Na2Y��ˮ��Һ�У�c��Y2-��+c��HY-��+c��H2Y��=0.1000 mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ̼ | �� | Y | |
| X | �� | Z |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ư����Һ�ڿ�����ʧЧ��ClO-+CO2+H2O�THClO+HCO3- | |
| B�� | ������Һ�еμӹ��������Ag��NH3��2++2H+�TAg++2NH4+ | |
| C�� | ������������ϡ���ᷴӦ��3Fe+2NO3-+8H+�T3Fe2++2NO��+4H2O | |
| D�� | ��ǿ����Һ�д���������Fe��OH��3��Ӧ����Na2FeO4��3ClO-+2Fe��OH��3�T2FeO42-+3Cl-+H2O+4H+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | KC1 | B�� | SiO2 | C�� | SO3 | D�� | NaOH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1.8 g D2O����NA������ | |
| B�� | ��״���£�22.4 L�����й��ۼ���ĿΪ19NA | |
| C�� | 5.35 g NH4Cl�����к���N-H���ĸ���Ϊ0.4NA | |
| D�� | �����½�0.1 mol FeͶ��������Ũ�����У�ת�Ƶĵ�����Ϊ0.3NA |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com